下列叙述中正确的是( )
A.含a mol AlCl3的溶液和含1.5a mol NaOH的溶液,无论正滴和反滴,生成的Al(OH)3的质量相等
B.含a mol Na2CO3的溶液和含1.5a mol HCl的稀盐酸,无论正滴和反滴,生成的CO2相等
C.等物质的量的NaHCO3和Na2CO3分别与足量盐酸反应.在同温同压下,生成的CO2体积相同
D.将盛有24mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后还剩余4 mL无色气体,则原混合气体中O2的体积是8 mL 或 1.2mL
【答案】
分析:A.AlCl
3溶液和NaOH溶液反应,正滴开始时NaOH过量,反滴开始时AlCl
3过量,最终生成的Al(OH)
3的质量相等;
B.Na
2CO
3溶液和稀盐酸,正滴开始时盐酸过量,有气体生成,反滴开始时Na
2CO
3过量,无气体生成,当碳酸钠全部转化为碳酸氢钠后,再滴盐酸,才有气体生成;
C.等物质的量的NaHCO
3和Na
2CO
3,与足量盐酸反应,生成的CO
2物质的量相同;
D.NO
2和O
2的混合气体的量筒倒立于水槽中反应生成硝酸,如果二氧化氮过量,过量的二氧化氮与水反应,剩余气体为一氧化氮,如果氧气过量,剩余气体为氧气;
解答:A. a mol AlCl
3和1.5a mol NaOH,AlCl
3溶液和NaOH溶液反应,正滴开始时,NaOH过量,
AlCl
3+4NaOH=NaAlO
2+2H
2O+3NaCl
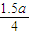
mol 1.5a mol
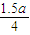
mol
当NaOH全部反应完,发生反应 AlCl
3 +3NaAlO
2+6H
2O=3NaCl+4Al(OH)
3↓,
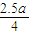
mol
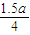
mol 0.5a mol
最终生成的Al(OH)
3的物质的量为 0.5a mol,剩余 AlCl
3 0.5a mol;
反滴开始时AlCl
3过量,根据反应:
AlCl
3+3NaOH=Al(OH)
3↓+3NaCl
a mol 1.5a mol a mol
知生成沉淀为 a mol Al(OH)
3,无NaOH剩余,故无Al(OH)
3+NaOH═NaAlO
2+2H
2O 反应.最终生成的沉淀为
a mol Al(OH)
3. 故A错误;
B.含a mol Na
2CO
3的溶液和含1.5a mol HCl的稀盐酸,正滴开始时盐酸过量,
2HCl+Na
2CO
3=2NaCl+CO
2↑+H
2O,
1.5amol amol a mol 0.75amol
最终生成生成 0.75amol CO
2,剩余 0.25amol Na
2CO
3;
反滴开始时Na
2CO
3过量,无气体生成,
Na
2CO
3+HCl=NaHCO
3+NaCl,
amol 1.5amol a mol
生成a mol NaHCO
3,剩余 0.5amolHCl,
再滴盐酸,NaHCO
3+HCl=NaCl+H
2O+CO
2↑
amol 0.5amol 0.5amol
最终生成生成0.5amolCO
2,剩余 0.5amol NaHCO
3. 故B错误;
C.等物质的量的NaHCO
3和Na
2CO
3,各取a mol,与足量盐酸反应,分别发生反应:
2HCl+Na
2CO
3=2NaCl+CO
2↑+H
2O,NaHCO
3+HCl=NaCl+H
2O+CO
2↑
amol amol amol amol
最终生成的气体二氧化碳,物质的量相同,在同温同压下,生成的CO
2体积相同.故C正确;
D.剩余4 mL无色气体,有两种情况:
①O
2少量,剩余的4ml气体是过量的NO
2和水反应生成的NO.
3NO
2+H
2O═2HNO
3+NO
所以和水反应的NO
2:V=4×3=12ml
所以反应的NO
2和O
2体积之和=24-12=12ml,根据4NO
2+O
2+2H
2O=4HNO
3,
所以原混合气体中O
2的体积V=12ml×

=2.4ml;
②O
2过量,剩余的4ml气体是O
2,根据4NO
2+O
2+2H
2O=4HNO
3,
所以反应的NO
2和O
2体积之和V=24ml-4ml=20ml
所以原混合气体中O
2的体积V=20ml×

+4ml=8ml则原混合气体中O2的体积是8 mL 或 1.2mL.故D错误;
故选C.
点评:该题主要考查了元素铝、碳、氮相关物质的性质,解题关键在于理解物质间化学反应的原理.平时学习应理解记忆有关反应方程式.

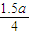 mol 1.5a mol
mol 1.5a mol 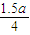 mol
mol 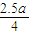 mol
mol 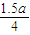 mol 0.5a mol
mol 0.5a mol  =2.4ml;
=2.4ml; +4ml=8ml则原混合气体中O2的体积是8 mL 或 1.2mL.故D错误;
+4ml=8ml则原混合气体中O2的体积是8 mL 或 1.2mL.故D错误;

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案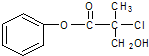 有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )
有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )