
分析 (1)25℃时,中性溶液中,c(OH-)=c(H+)=1×10-7mol/L,根据电荷守恒得c(Na+ )=c(Cl-),据此计算溶液中c(Na+ ):c(OH-);
(2)二者体积相等,n(NaOH):n(H2SO4)=C(NaOH):C(H2SO4)=0.1mol/L:0.06mol/L=5:3,NaOH和H2SO4以2:1反应,所以硫酸有剩余,溶液呈酸性;
(3)纯水中,c(H+)=c(OH-),据此计算该温度下的Kw,任何溶液中,Kw=c(H+)•c(OH-)都成立.
解答 解:(1)25℃时,中性溶液中,c(OH-)=c(H+)=1×10-7mol/L,根据电荷守恒得c(Na+ )=c(Cl-),据此计算溶液中c(Na+ ):c(OH-)=1×10-4 mol/L:1×10-7 mol/L=1000:1,
故答案为:1000:1;
(2)二者体积相等,n(NaOH):n(H2SO4)=C(NaOH):C(H2SO4)=0.1mol/L:0.06mol/L=5:3,NaOH和H2SO4以2:1反应,所以硫酸有剩余,溶液呈酸性,溶液中c(H+ )=$\frac{0.06mol/L×2-0.1mol/L}{2}$=0.01mol/L,则溶液中pH=2,
故答案为:2;
(3)纯水中,c(H+)=c(OH-)=5.0×10-7 mol/L,所以该温度下的Kw=c(H+)•c(OH-)=2.5×10-13mol2/L2,酸溶液中,Kw=c(H+)•c(OH-),当c(H+)=5.0×10-3mol/L,则c(OH-)=$\frac{1{0}^{-14}}{5.0×1{0}^{-3}}$mol/L=5.0×10-11mol/L,NaOH溶液中的c(OH-)=5.0×10-2 mol/L,则溶液中c(H+ )=$\frac{1{0}^{-14}}{5.0×1{0}^{-2}}$mol/L=5.0×10-12mol/L,
故答案为:5.0×10-7mol/L;5.0×10-11mol/L;5.0×10-12mol/L.
点评 本题考查pH的简单计算,先确定是否发生反应,再计算溶液中氢离子浓度,从而计算溶液pH,注意温度不同水的离子积不同,侧重考查计算能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氧化镁与稀硝酸反应:O2-+2H+═H2O | |
| B. | 向稀硫酸溶液中撒入铁粉 2Fe+6H+=2Fe3++3H2↑ | |
| C. | 向碳酸钙中加入盐酸 CO32-+2H+=H2O+CO2↑ | |
| D. | 向氢氧化钠溶液中通入少量二氧化碳 2OH-+CO2=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
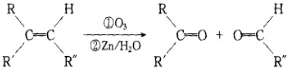
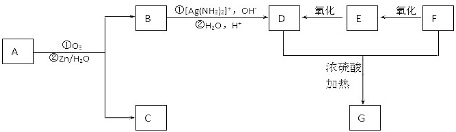
 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素处于最高价态时一定有强氧化性 | |
| B. | 含氧酸的价态越高,氧化性一定越强 | |
| C. | 金属元素被还原,不一定得到金属单质 | |
| D. | 氧化还原反应的本质是元素化合价的升降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏实验时,应将温度计水银球置于蒸馏烧瓶支管口处 | |
| B. | 蒸馏实验时,冷水从冷凝管下口入,上口出 | |
| C. | 萃取使用的主要仪器是分液漏斗,在使用前要先检验其是否漏液 | |
| D. | 萃取实验时,应先后将上下两层液体从下口放出,并用不同烧杯盛放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CF4 CBr4 CsCl SiO2 | B. | SiO2 CsCl CF4 CBr4 | ||
| C. | CsCl SiO2 CBr4 CF4 | D. | SiO2 CsCl CBr4 CF4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3═Na2++CO32- | B. | NaHCO3═Na++HCO3- | ||
| C. | KClO3═K++Cl-+3O 2- | D. | H2SO4═H++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com