
| A. | NaHSO4═Na++HSO4- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2CO3?2H++CO32- | D. | A12(SO4)3═2A13++3SO42- |
分析 强电解质在水溶液里完全电离生成阴阳离子,电离方程式写“=”,弱电解质在水溶液里部分电离,电离方程式写“?”,
A.硫酸氢根离子应该拆开;
B.碳酸氢钠电离出碳酸氢根离子和钠离子,碳酸氢根离子不能拆开;
C.碳酸的电离分步进行,电离方程式分步书写;
D.硫酸铝完全电离出铝离子和硫酸根离子.
解答 解:A.硫酸氢钠是强电解质,在水溶液里完全电离生成钠离子、氢离子和硫酸根离子,正确的电离方程式为:NaHSO4═Na++H++SO42-,故A错误;
B.碳酸氢根离子不能拆开,正确的电离方程式为:NaHCO3═Na++HCO3-,故B错误;
C.碳酸为二元弱酸,电离方程式应该分步书写,主要写出第一步电离即可,正确的电离方程式为:H2CO3?H++HCO3-,故C错误;
D.硫酸铝为强电解质,在溶液中完全电离,其电离方程式为:Al2(SO4)3═2A13++3SO42-,故D正确;
故选D.
点评 本题考查了电离方程式的书写,题目难度中等,明确电解质的强弱及电离方程式的书写规则是解本题关键,知道电解质电离出的阴阳离子分别是什么,注意一般情况下原子团不能拆开,为易错点,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
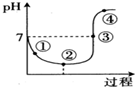 氯气对水杀菌消毒体系中起杀菌作用的主要是HClO.25℃时氯气-氯水体系中存在以下平衡关系:
氯气对水杀菌消毒体系中起杀菌作用的主要是HClO.25℃时氯气-氯水体系中存在以下平衡关系:| A. | 用氯气对水杀菌消毒,夏季要比冬季好 | |
| B. | Cl2(g)+H2O?HClO+H++Cl- K=10-4.6 | |
| C. | 图中点③所示溶液中,c(Na+)=c(Cl-) | |
| D. | 图中点②所示溶液中水的电离程度大于点①所示溶液中水的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知:2SO2(g)+O2═2SO3(g)△H=-196.6kJ•mol-1,2NO(g)+O2═2NO2(g)△H=-113.0kJ•mol-1.则反应NO2(g)+SO2(g)═SO3(g)+NO(g) 的△H=-41.8kJ/mol.
(1)已知:2SO2(g)+O2═2SO3(g)△H=-196.6kJ•mol-1,2NO(g)+O2═2NO2(g)△H=-113.0kJ•mol-1.则反应NO2(g)+SO2(g)═SO3(g)+NO(g) 的△H=-41.8kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
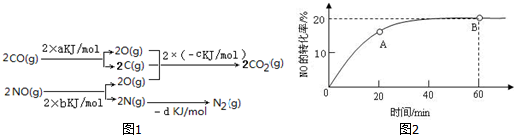
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
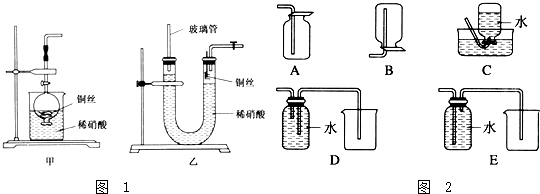
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 Na2CO3和NaHCO3是两种常见的钠盐.
Na2CO3和NaHCO3是两种常见的钠盐.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com