
| A. | KHCO3 | B. | AlCl3 | C. | Na2SO3 | D. | Fe2(SO4)3 |
分析 从盐类水解的角度和物质的稳定性的角度分析,注意当水解生成挥发性酸时,加热蒸干并灼烧最终得到的是金属氧化物,另外,加热易分解、易氧化的物质不能得到原物质,比如碳酸氢钠、高锰酸钾、氯酸钾等,以此解答该题.
解答 解:A.碳酸氢钾灼烧分解生成碳酸钾、二氧化碳和水,最终得到的固体为碳酸钾,故A错误;
B.AlCl3溶液加入水解生成氢氧化铝和盐酸,盐酸挥发,灼烧生成氧化铝,故B错误;
C.Na2SO3不稳定,加热易被空气中氧气氧化,故C错误;
D.因硫酸难挥发,最终仍得到2(SO4)3,故D正确;
故选D.
点评 本题考查盐类水解的应用,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意盐类水解的原理,特别是能把握相关物质的性质.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
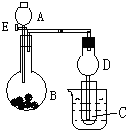 用如图所示装置进行实验,将A逐滴加入B中:
用如图所示装置进行实验,将A逐滴加入B中:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
类别 选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
| A | 生理盐水 | 明矾 | 液态KNO3 | 蔗糖 |
| B | CaO | 海 水 | 铜 | 乙醇 |
| C | 胆矾 | 铝合金 | AgCl | CO2 |
| D | 氢氧化钠 | 空气 | Na2SO4溶液 | 食醋 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:10:104:109 | B. | 1:5:5×109:5×108 | C. | 1:20:1010:109 | D. | 1:10:1010:109 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
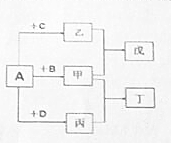 短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2.在一定条件下可以发生如图所示的化合反应.
短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2.在一定条件下可以发生如图所示的化合反应. ,若将甲通入乙中所得溶液PH大于7,用方程式表示溶液PH大于7 的原因:NH3•H2O?NH4++OH-.
,若将甲通入乙中所得溶液PH大于7,用方程式表示溶液PH大于7 的原因:NH3•H2O?NH4++OH-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com