
2H2O(g) ====2H2(g)+O2(g);ΔH=Q2 kJ·mol-1
CH4(g)+2O2(g) ====CO2(g)+2H2O(l);ΔH=-Q3 kJ·mol-1,则H2和CH4的燃烧热之比是
A.![]() B.
B. ![]() C.
C.![]() D.
D.![]()
科目:高中化学 来源: 题型:
H2(g)+![]() O 2(g)
O 2(g)![]() H2O(l)ΔH=-285.8 kJ·mol-1;C3H8(g)+5O2(g)
H2O(l)ΔH=-285.8 kJ·mol-1;C3H8(g)+5O2(g) ![]() 3CO2(g)+4H2O(l)
3CO2(g)+4H2O(l)
ΔH=-2 220.0 kJ·mol-1。
(1)实验测得H2和C3H8的混合气体共5 mol,完全燃烧生成液态水时放热6 264.5 kJ,混合气体中H2和C3H8的体积比______________________。
(2)已知:H2O(l)![]() H2O(g) ΔH=+44.0 kJ·mol-1;写出丙烷燃烧生成CO2和气态水的热化方程式_____________________________________________________________________。
H2O(g) ΔH=+44.0 kJ·mol-1;写出丙烷燃烧生成CO2和气态水的热化方程式_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省唐山一中高一下学期期中考试化学试卷(带解析) 题型:填空题
已知0.4 mol液态肼(N2H4)与过量的液态双氧水反应,生成氮气和水蒸气,放出256.65 kJ的热量,该反应的热化学方程式为 。
又已知:H2O(l)=H2O(g) ΔH =+44 kJ/mol,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年黑龙江省高二上学期期中化学试卷(解析版) 题型:填空题
(8分)(1)肼(N2H4)是发射航天飞船常用的高能燃料。将NH3和NaClO按一定物质的量比混合反应,生成肼、NaCl和水,该反应的化学方程式是_____________________________。
(2)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量气体,并放出大量热。已知:H2O(l) H2O(g) ΔH= +44 kJ/mol。12.8 g液态肼与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量。
①请写出液态肼与过氧化氢反应生成液态水的热化学方程式______________________。
②则16 g 液态肼与足量过氧化氢反应生成液态水时放出的热量是___________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省苏中三市高三5月第二次调研测试化学试卷(解析版) 题型:填空题
(14分)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:2CO(g)+4H2 (g)  CH3CH2OH(g)+H2O(g)
△H=—256.1kJ·mol—1。
CH3CH2OH(g)+H2O(g)
△H=—256.1kJ·mol—1。
已知:H2O(l)=H2O(g) △H=+44kJ·mol—1
CO(g)+H2O(g) CO2(g)+H2(g)
△H=—41.2kJ·mol—1
CO2(g)+H2(g)
△H=—41.2kJ·mol—1
⑴以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(l)
△H= 。
CH3CH2OH(g)+3H2O(l)
△H= 。
⑵CH4和H2O(g)在催化剂表面发生反应CH4+H2O CO+3H2,该反应在不同温度下的化学平衡常数如下表:
CO+3H2,该反应在不同温度下的化学平衡常数如下表:
|
温度/℃ |
800 |
1000 |
1200 |
1400 |
|
平衡常数 |
0.45 |
1.92 |
276.5 |
1771.5 |
①该反应是_____反应(填“吸热”或“放热”);
②T℃时,向1L密闭容器中投入1molCH4和1mol H2O(g),平衡时c(CH4)=0.5mol·L—1,该温度下反应CH4+H2O CO+3H2的平衡常数K= 。
CO+3H2的平衡常数K= 。
⑶汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5 为催化剂,测得NO转化为N2的转化率随温度变化情况如图。
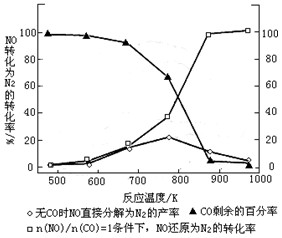
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在 左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染。写出CH4与NO2发生反应的化学方程式: 。
⑷乙醇-空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2—离子。该电池负极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com