
| A.②③ | B.①③ | C.①②③ | D.②③④ |
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.合成氨生产过程中升高温度可加快反应速率,缩短生产周期,故温度越高越好 |
| B.硫酸工业中,使用催化剂是为了提高SO2转化为SO3的转化率 |
| C.电解精炼铜时,精铜作阴极 |
| D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫酸工业中制SO3的反应条件是:高温、高压、催化剂 |
| B.合成氨气的条件是:400—500 ℃、10Mpa —30 MPa、铁触媒 |
| C.都进行了循环操作 |
| D.都有热交换装置 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g);△H=-92.44 kJ/mol;其部分工艺流程如下:
2NH3(g);△H=-92.44 kJ/mol;其部分工艺流程如下: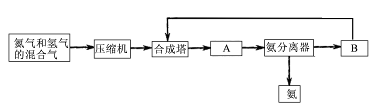
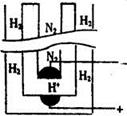
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
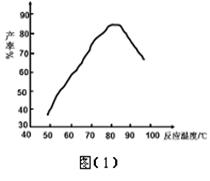
 H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑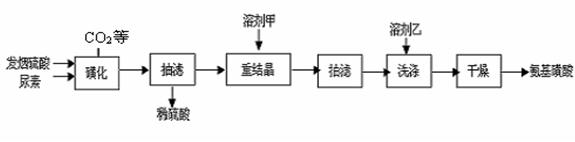

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
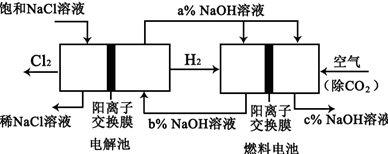
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
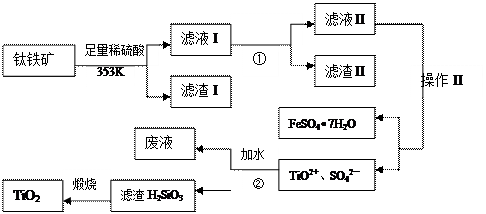
| A.Fe | B.Ca(OH)2 | C.NH3?H2O | D.NaOH |
 生的反应为:
生的反应为: 92),则产品中硫酸亚铁铵晶体纯度的计算式可表达为:w%= 。
92),则产品中硫酸亚铁铵晶体纯度的计算式可表达为:w%= 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com