

分析 (1)反应物吸收能量断裂化学键形成活化分子发生化学反应,图象分析计算反应焓变△H=+206.1 kJ/mol,标注物质聚集状态和对应反应焓变写出热化学方程式,△G=△H-T△S<0时反应才能自发进行,结合反应焓变和熵变分析判断反应自发进行的条件;
(2)A.根据坐标图可知,逆反应的活化能很小;
B.反应体系存在H2O+CO?CO2+H2反应,所以恒温恒容时充入一定量CO2,可促进产物中的H2反应,提高CH4的平衡转化率,并适当减少H2的物质的量增加CO的物质的量,调节CO和H2的比例;
C.由于使用高效催化剂,同时降低正逆反应的活化能;
D.若恒温恒容时充入少量Ar,原平衡各气体浓度不变,平衡不移动,但若是在恒温恒压时充入少量Ar,容器容积扩大,相当于减小原平衡体系的压强,平衡正向移动;
E.反应体系存在H2O+CO?CO2+H2反应;
(3)x增大开始阶段氢气体积分数增大,随比值增大,加入其它体积占主要成分,氢气体积分数减小,产率减小,据此画出图象变化,相同温度下压强越大平衡向气体体积减小的方向进行,则平衡逆向进行,CO体积分数φ(CO)减小;T<450℃时,几乎不反应,p改变对φ(CO)几乎无影响;T≥1000℃时,φ(CO)已经很大;
(4)CH4(g)+H2O(g)?CO(g)+3H2(g)
起始(mol) $\frac{n}{2}$ $\frac{n}{2}$ 0 0
变化(mol) $\frac{nα}{2}$ $\frac{nα}{2}$ $\frac{nα}{2}$ $\frac{3nα}{2}$
平衡(mol) $\frac{(1-α)n}{2}$ $\frac{(1-α)n}{2}$ $\frac{nα}{2}$ $\frac{3nα}{2}$
即气体体积为(1+α)V
平衡各气体浓度(mol/L) $\frac{(1-α)n}{2(1+α)V}$ $\frac{(1-α)n}{2(1+α)V}$ $\frac{nα}{2(1+α)V}$ $\frac{3nα}{2(1+α)V}$
平衡各气体含量 $\frac{(1-α)}{2(1+α)}$ $\frac{(1-α)}{2(1+α)}$ $\frac{n}{2(1+α)}$ $\frac{3a}{2(1+α)}$
平衡各气体分压 $\frac{(1-α)p}{2(1+α)}$ $\frac{(1-α)p}{2(1+α)}$ $\frac{np}{2(1+α)}$ $\frac{3αp}{2(1+α)}$
据此计算平衡常数;
解答 解:(1)能量大于E1的分子称作活化分子,图象分析计算反应焓变△H=+206.1 kJ/mol,甲烷水蒸气重整法制合成气的热化学方程式为CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1 kJ/mol,
△G=△H-T△S<0时反应才能自发进行.此反应的△H>0且为熵增过程△S>0,只有高温才能使△G=△H-T△S<0.
故答案为:活化分子;CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1 kJ/mol;高温;
(2)A.根据坐标图可知,逆反应的活化能很小,所以逆反应很易发生,故A正确;
B.反应体系存在H2O+CO?CO2+H2反应,所以恒温恒容时充入一定量CO2,可促进产物中的H2反应,提高CH4的平衡转化率,并适当减少H2的物质的量增加CO的物质的量,调节CO和H2的比例,故B正确;
C.由于使用高效催化剂,同时降低正逆反应的活化能,所以某可逆反应的正反应使用的催化剂一定也是逆反应的催化剂,故C正确;
D.若恒温恒容时充入少量Ar,原平衡各气体浓度不变,平衡不移动,但若是在恒温恒压时充入少量Ar,容器容积扩大,相当于减小原平衡体系的压强,平衡正向移动,故D错误;
E.反应体系存在H2O+CO?CO2+H2反应,故E正确;
故答案为:ABCE;
(3)在恒容密闭容器中充入物质的量之比值为x的CH4和H2O(g)混合气体,相同温度下测得H2平衡产率与x的关系如图2所示,x增大开始阶段氢气体积分数增大,随比值增大,加入其它体积占主要成分,氢气体积分数减小,产率减小,在图中作出平衡时H2体积分数φ(H2)与x的变化曲线为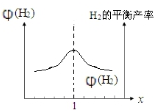 ,当充入CH4和H2O(g)物质的量之比1:2.2时,温度、压强p对平衡时CO体积分数φ(CO)的影响如图3:相同温度下压强越大平衡向气体体积减小的方向进行,则平衡逆向进行,CO体积分数φ(CO)减小,则压强大小为p3>p2>p1,当T<450℃和T≥1000℃时,压强p对φ(CO)几乎无影响的原因是T<450℃时,几乎不反应,p改变对φ(CO)几乎无影响;T≥1000℃时,φ(CO)已经很大(≈18%),甲烷的平衡转化率已达到90%以上(考虑副反应,甲烷的平衡转化率更大),p改变对φ(CO)影响很小,
,当充入CH4和H2O(g)物质的量之比1:2.2时,温度、压强p对平衡时CO体积分数φ(CO)的影响如图3:相同温度下压强越大平衡向气体体积减小的方向进行,则平衡逆向进行,CO体积分数φ(CO)减小,则压强大小为p3>p2>p1,当T<450℃和T≥1000℃时,压强p对φ(CO)几乎无影响的原因是T<450℃时,几乎不反应,p改变对φ(CO)几乎无影响;T≥1000℃时,φ(CO)已经很大(≈18%),甲烷的平衡转化率已达到90%以上(考虑副反应,甲烷的平衡转化率更大),p改变对φ(CO)影响很小,
故答案为: ;p3>p2>p1;T<450℃时,几乎不反应,p改变对φ(CO)几乎无影响;T≥1000℃时,φ(CO)已经很大(≈18%),甲烷的平衡转化率已达到90%以上(考虑副反应,甲烷的平衡转化率更大),p改变对φ(CO)影响很小;
;p3>p2>p1;T<450℃时,几乎不反应,p改变对φ(CO)几乎无影响;T≥1000℃时,φ(CO)已经很大(≈18%),甲烷的平衡转化率已达到90%以上(考虑副反应,甲烷的平衡转化率更大),p改变对φ(CO)影响很小;
(4)CH4(g)+H2O(g)?CO(g)+3H2(g)
起始(mol) $\frac{n}{2}$ $\frac{n}{2}$ 0 0
变化(mol) $\frac{nα}{2}$ $\frac{nα}{2}$ $\frac{nα}{2}$ $\frac{3nα}{2}$
平衡(mol) $\frac{(1-α)n}{2}$ $\frac{(1-α)n}{2}$ $\frac{nα}{2}$ $\frac{3nα}{2}$
即气体体积为(1+α)V
平衡各气体浓度(mol/L) $\frac{(1-α)n}{2(1+α)V}$ $\frac{(1-α)n}{2(1+α)V}$ $\frac{nα}{2(1+α)V}$ $\frac{3nα}{2(1+α)V}$
平衡各气体含量 $\frac{(1-α)}{2(1+α)}$ $\frac{(1-α)}{2(1+α)}$ $\frac{n}{2(1+α)}$ $\frac{3a}{2(1+α)}$
平衡各气体分压 $\frac{(1-α)p}{2(1+α)}$ $\frac{(1-α)p}{2(1+α)}$ $\frac{αp}{2(1+α)}$ $\frac{3αp}{2(1+α)}$
Kc=$\frac{\frac{αn}{2(1+α)V}×[\frac{3αn}{2(1+α)V}]^{3}}{[\frac{(1-α)n}{2(1+α)V}]^{2}}$=$\frac{27{a}^{4}{n}^{2}}{4(1-{a}^{2})^{2}{V}^{2}}$,
Kp=$\frac{\frac{αp}{2(1+α)}×[\frac{3αp}{2(1+α)}]^{3}}{[\frac{(1-α)p}{2(1+α)}]^{2}}$=$\frac{27{a}^{4}{p}^{2}}{4(1-{a}^{2})^{2}}$,
故答案为:Kc=$\frac{27{a}^{4}{n}^{2}}{4(1-{a}^{2})^{2}{V}^{2}}$或Kp=$\frac{27{a}^{4}{p}^{2}}{4(1-{a}^{2})^{2}}$.
点评 本题考查了热化学方程式书写、化学平衡影响因素、图象分析判断、平衡常数概念的计算应用,注意体积分数计算和分压计算平衡常数的方法,题目难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管用蒸馏水洗净后,直接加入已知物质的量浓度的盐酸 | |
| B. | 锥形瓶用蒸馏水洗净后再用NaOH润洗,再加人一定体积待测NaOH溶液 | |
| C. | 滴定时,没有逐出滴定管尖嘴的气泡,滴定后气泡消失 | |
| D. | 读数时,视线与滴定管内液体的凹液面最低处保持一致 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
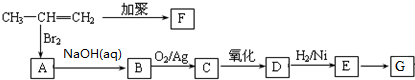
 .聚合物G的结构简式
.聚合物G的结构简式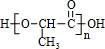 _
_ .
.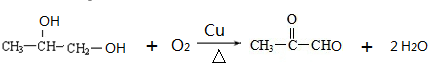 .
.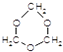 B.
B.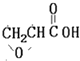 C.
C.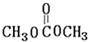 D.HOCH2CH2COOH.
D.HOCH2CH2COOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据以上信息,可推断CH3COOH为弱电解质 | |
| B. | 加水稀释过程中,c(H+)•c(OH-) 的值增大 | |
| C. | 加入NaOH固体可抑制 CHCOO-的水解 | |
| D. | 同pH的CH3COONa溶液和NaOH溶液,由水电离出的c(H+) 前者大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
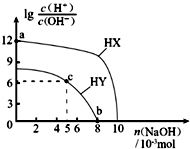 25℃,在100mL 0.1mol?L-1的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述不正确的是( )
25℃,在100mL 0.1mol?L-1的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述不正确的是( )| A. | 酸性:HX>HY | |
| B. | a点由水电离出的c(H+)=10-12 mol?L-1 | |
| C. | c点溶液中:c(Y-)>c(HY) | |
| D. | b点时,溶液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCl2和足量的铁加热条件下反应,转移电子数一定为3NA | |
| B. | 28g乙烯和丙烯的混合物中含有双键数目小于NA | |
| C. | 常温下,PH=13的Ba(OH)2 溶液,0.1L,含OH-,0.02NA | |
| D. | 1 L 1 mol/L的甲醇水溶液中含有氢原子总数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 室温下向1 L pH=1的醋酸溶液中加水,所得溶液的OH-数目大于0.1NA | |
| B. | 60g乙酸与足量乙醇发生酯化反应,充分反应后乙酸断裂的C-O键数目为NA | |
| C. | 已知C2H4(g)+H2(g)=C2H6(g)△H=-137.0 kI/mol,乙烯与H2加成时放出68.5 kJ热量,则 反应过程中被破坏的碳原子之间共用电子对数目为NA | |
| D. | 4.6gSO2、NO2混合气体中含有中子数为2.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 BHC≡CHCCH2=CH2D
BHC≡CHCCH2=CH2D ECH3CH3.
ECH3CH3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com