
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①②③④ |
分析 先根据元素化合价变化来确定氧化剂、还原剂,再根据方程式中氧化剂和还原剂的计量数之比判断即可.
解答 解:①2Na+2H2O=2NaOH+H2↑,该反应中钠是还原剂,水是氧化剂,氧化剂和还原剂的物质的量之比为1:1,故正确;
②Cl2+H2O=HCl+HClO中,氯元素的化合价由0价变为-1价和+1价,所以氧化剂和还原剂都是氯气,每个氯原子得电子或失电子个数相等,所以氧化剂和还原剂的物质的量之比为1:1,故正确;
③2Na2O2+2H2O=4NaOH+O2↑,该反应中氧元素的化合价由-1价变为0价和-2价,所以过氧化钠既是氧化剂又是还原剂,每个过氧化钠化学式中氧原子得失数相等,所以氧化剂和还原剂的物质的量之比为1:1,故正确;
④反应3NO2+H2O═2HNO3+NO,NO2为既是氧化剂,又是还原剂,参加反应的氧化剂与还原剂物质的量之比为1:2,故错误;
故选A.
点评 本题考查了氧化还原反应的有关计算,正确书写方程式是解本题关键,再根据方程式中各物理量的关系来分析解答,难度不大.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |||||||||
| B. | 25℃、101kPa时,1mol S和2mol S的燃烧热不相等 | |||||||||
| C. | 通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能,例如:
| |||||||||
| D. | 任何化学反应都伴随着能量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测溶液的pH一定会有误差 | |
| B. | 用标准盐酸溶液滴定未知浓度的NaOH溶液时,用待测溶液润洗锥形瓶 | |
| C. | 用酸式滴定管量取酸性高锰酸钾溶液5.10mL | |
| D. | 用标准盐酸溶液滴定未知浓度NaOH溶液的过程中不慎将锥形瓶中的溶液溅出,会使测得的NaOH溶液的浓度偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应是由于反应物的总能量比生成物的总能量低 | |
| B. | 放热反应的△H>0 | |
| C. | 需要加热才能发生反应不一定是吸热反应 | |
| D. | 酸碱中和反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v正(C):v逆(H2)=1:1的状态 | |
| B. | 用H2O、CO、H2的物质的量浓度变化表示的反应速率的比为1:1:1的状态 | |
| C. | 混合气体的密度不再改变的状态 | |
| D. | 当平衡常数K不发生改变的时候 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40% | B. | 28.6% | C. | 37.5% | D. | 62.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2O2 Al2(SO4)3 MgCl2 K2CO3 | B. | BaCl2 Na2SO4 CaCO3 KOH | ||
| C. | AgNO3 NaCl KCl CuCl2 | D. | Fe2(SO4)3 K2CO3 KHSO4 BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③④⑤ | C. | ①③⑤ | D. | ①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
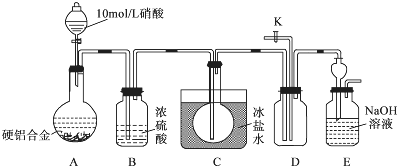
| 金属离子 | 开始沉淀时的pH | 沉淀完全的pH |
| Al3+ | 3.4 | 4.7 |
| Cu2+ | 4.1 | 6.9 |
| Mg2+ | 9.4 | 12.4 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com