
 A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其简单氢化物能相互反应生成盐;C元素原子的最外层电子数是内层电子数的3倍;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍.G单质是日常生活中用量最大的金属,易被腐蚀.
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其简单氢化物能相互反应生成盐;C元素原子的最外层电子数是内层电子数的3倍;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍.G单质是日常生活中用量最大的金属,易被腐蚀.分析 A、B、C、D、E、F 六种短周期元素,它们的原子序数依次增大,A是周期表中原子半径最小的元素,则A为H元素;B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐,则B为N元素;C元素原子的最外层电子数是其内层电子数的3倍,原子只能有2个电子数,最外层电子数为6,故C为O元素;D元素的主族序数等于其周期数,原子序数大于氧,只能处于第三周期,故D为Al;E元素原子的最外层电子数是其电子层数的2倍,原子序数大于Al,处于第三周期,最外层电子数为6,故E为S元素;G单质是日常生活中用量最大的金属,易被腐蚀,则G为Fe.
解答 解:A、B、C、D、E、F 六种短周期元素,它们的原子序数依次增大,A是周期表中原子半径最小的元素,则A为H元素;B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐,则B为N元素;C元素原子的最外层电子数是其内层电子数的3倍,原子只能有2个电子数,最外层电子数为6,故C为O元素;D元素的主族序数等于其周期数,原子序数大于氧,只能处于第三周期,故D为Al;E元素原子的最外层电子数是其电子层数的2倍,原子序数大于Al,处于第三周期,最外层电子数为6,故E为S元素;G单质是日常生活中用量最大的金属,易被腐蚀,则G为Fe.
(1)A为H元素,其同位素有:1H、2H、3H,故答案为:1H、2H、3H;
(2)B的简单氢化物为NH3,实验室制取氨气的化学反应方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->Cl->O2->Al3+,
故答案为:S2->Cl->O2->Al3+;
(4)水比硫化氢稳定等可以说明氧元素非金属性比硫的强,
故答案为:H2O比H2S稳定;
(5)A.在人体内的血红蛋白中含有铁元素,铁位于第四周期Ⅷ族,故A错误;
B.过量的铁与氯气反应生成氯化铁,而Fe与稀盐酸反应生成氯化亚铁,故B错误;
C.氯气与Fe反应生成FeCl3,Fe与氯化铁反应生成FeCl2,氢氧化亚铁氧化生成Fe(OH)3,都可以通过化合反应制取,故C正确;
D.铁离子具有强氧化性,可以氧化碘离子,氢氧化铁与HI溶液发生中和反应外,还发生氧化还原反应,故D错误,
故选:ABD;
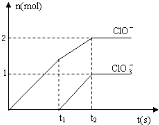
(6)根据图象知,次氯酸根离子的物质的量为0.2mol,氯酸根离子的物质的量为0.1mol,根据电子转移守恒可知生成氯离子为$\frac{0.2mol×1+0.1mol×5}{1}$=0.7mol,所以次氯酸根离子、氯酸根离子、氯离子的物质的量之比为2:1:7,t2时氯气和氢氧化钠的反应方程式为:5Cl2+10NaOH=7NaCl+2NaClO+NaClO3+5H2O,
故答案为:5Cl2+10NaOH=7NaCl+2NaClO+NaClO3+5H2O.
点评 本题考查结构性质位置关系应用,正确推断元素是解题关键,侧重考查学生对知识的迁移运用,(6)中注意利用电子转移守恒解答,掌握金属性、非金属性强弱比较实验事实,难度中等.


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl 和NaOH | B. | Na2O 和Na2O2 | C. | CaCl2 和 Na2S | D. | CO2 和 CaO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第七周期0族 | B. | 第七周期第ⅦA族 | C. | 第八周期第ⅠA族 | D. | 第八周期第ⅡA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com