
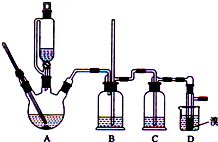
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
分析 实验室制备1,2-二溴乙烷:三颈烧瓶A中乙醇在浓硫酸的作用下发生分子内脱水生成乙烯,乙醇发生了消去反应,反应方程式为:CH3CH2OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
如果D中导气管发生堵塞,A中产生的乙烯气体会导致装置B中压强增大,长导管液面会上升,所以装置B中长玻璃管可检验D装置是否堵塞,装置B起缓冲作用,浓硫酸具有脱水性、吸水性和强氧化性,能氧化乙醇,方式的反应为CH3CH2OH+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4SO2↑+CO2↑+7H2O+C,可能生成的酸性气体为二氧化硫、二氧化碳,装置C中放氢氧化钠溶液,发生反应SO2+2NaOH=Na2SO3+H2O,CO2+2NaOH═Na2CO3+H2O,除去杂质气体,乙烯含有不饱和键C=C双键,能与卤素单质发生加成反应,D中乙烯和溴发生加成生成1,2-二溴乙烷,反应为:CH2=CH2+Br-Br→CH2Br-CH2Br,制得1,2-二溴乙烷;
(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水生成乙醚;
(2)C装置是吸收酸性气体,应该盛放碱性溶液;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色;
(4)1,2-二溴乙烷和水不互溶,且1,2-二溴乙烷密度比水大;
(5)常温下下Br2和氢氧化钠发生反应,可以除去混有的溴;
(6)互溶的液体采用蒸馏方法分离;
(7)溴易挥发,温度高时挥发更严重;1,2-二溴乙烷的凝固点较低(9℃).
解答 解:(1)乙醇在浓硫酸140℃的条件下,发生分子内脱水生成乙醚,可能迅速地把反应温度提高到170℃左右,其最主要目的是:减少副产物乙醚生成;
故答案为:D;
(2)C装置是吸收酸性气体,应该盛放碱性溶液,生成的酸性气体有二氧化碳、二氧化硫,NaOH和碳酸氢钠溶液为碱性溶液,但碳酸氢钠饱和溶液和二氧化碳不反应,所以应该选取NaOH溶液,
故答案为:C;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,D中溴颜色完全褪去说明反应已经结束,故答案为:溴的颜色完全褪去;
(4)1,2-二溴乙烷和水不互溶,应该采用分液方法分离,所有的仪器是分液漏斗,1,2-二溴乙烷密度比水大,有机层在下层,故答案为:分液漏斗;下;
(5)A.溴更易溶于1,2-二溴乙烷,用水无法除去溴,故A错误;
B.常温下Br2和氢氧化钠发生反应:2NaOH+Br2═NaBr+NaBrO+H2O,再分液除去,故B正确;
C.NaI与溴反应生成碘,碘与1,2-二溴乙烷互溶,不能分离,故C错误;
D.酒精与1,2-二溴乙烷互溶,不能除去混有的溴,故D错误,
故答案为:B;
(6)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离,故答案为:蒸馏;
(7)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却,过度冷却会使其凝固而使气路堵塞,
故答案为:冷却,避免溴的大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
点评 本题考查物质制备,为高频考点,涉及制备原理、物质的分离提纯、实验条件控制、对操作分析评价等,是对基础知识的综合考查,明确化学实验原理、物质性质差异性及实验操作规范性是解本题关键,注意题干信息的正确获取和灵活运用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温下,AgCl 在饱和 NaCl 溶液中的 KSP 比在纯水中的 KSP 小 | |
| B. | 向 AgCl 的悬浊液中加入 KI 溶液,沉淀由白色转化为黄色 | |
| C. | 将 0.001 mol•L-1 的 AgNO3 溶液滴入 KCl 和 KI 的混合溶液中,一定先产生 AgI 沉淀 | |
| D. | 向 AgCl 的饱和溶液中加入 NaCl 晶体,有 AgCl 析出且溶液中 c(Ag+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能kJ/mol | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
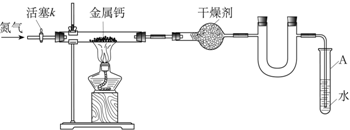
| 空硬玻璃管质量m0/g | 硬玻璃管与钙的质量m1/g | 硬玻璃管与产物的质量m2/g |
| 114.8 | 120.8 | 122.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.40mL |
| 第二次 | 3.00mL | 21.10mL |
| 第三次 | 0.20mL | 20.40mL |
| 第四次 | 0.00mL | 18.20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使 SO3 的浓度增大 | B. | 使平衡向正反应方向移动 | ||
| C. | 使平衡常数 K 增大 | D. | 使正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当电池负极消耗m g气体时,电解池阴极同时有m g气体生成 | |
| B. | 电池的正极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 电池中c(KOH)不变;电解池中溶液pH变大 | |
| D. | 电解后c(Na2CO3)不变,且溶液中有Na2CO3﹒10H2O晶体析出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com