
| A. | 6种 | B. | 9种 | C. | 10 种 | D. | 12 种 |
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 称取2.0gNaOH固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
| B | 配制MgCl2、AlCl3溶液中分别通入氨气 | 比较镁、铝的金属性强强弱 |
| C | 检验溶液中是否含有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
| D | 向NaBr溶液中滴入少量的氯水和CCl2,振荡、静置,溶液下层呈橙红色 | Cl-的还原性强于Br- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示.试回答:
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
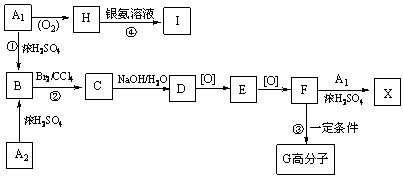
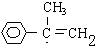 ; G
; G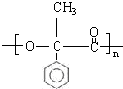 .反应C→D属于取代反应(填反应类型)
.反应C→D属于取代反应(填反应类型)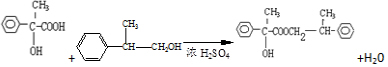 ;H→I反应的化学方程式
;H→I反应的化学方程式 .
.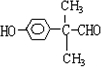 (任写一种即可).
(任写一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁胶体带正电 | |
| B. | 胶体加入电解质可产生沉淀,而溶液不能 | |
| C. | 由于胶体是一种介稳性的分散系,因此不易聚沉 | |
| D. | 胶体能够发生丁达尔现象,而溶液则不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,滴加几滴KSCN溶液,振荡 | 溶液呈血红色 | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,滴加几滴K3[Fe(CN)6]溶液,振荡 | 产生蓝色沉淀 | 存在Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com