
(分)膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。
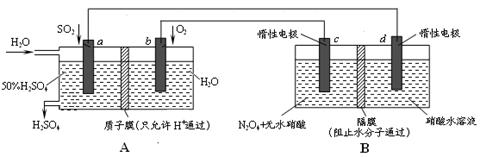
⑴A装置是________,B装置是_________(填“原电池”或“电解池”)。
⑵N2O5在电解池的______区生成,其电极反应式为_____________________________。
⑶通入O2一极的电极反应式为_______________________________。
⑷若通入SO2的速率为2.24 L·min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为_________mL·min-1。
⑴原电池(1分) 电解池(1分)
⑵阳极(1分) N2O4+2HNO3-2e-![]() 2N2O5+2H+(2分)
2N2O5+2H+(2分)
⑶O2+4H++4e-![]() 2H2O(2分)
2H2O(2分)
⑷13.4(2分)
本题是电解池和原电池的综合。由于B装置中c、d两极均为惰性电极,不符合构成原电池的条件,因此可推知A装置为原电池(可视作燃料电池),用来制备H2SO4,B装置为电解池,用来制备N2O5,A装置为B装置的电解提供电能。A中通入SO2的一极发生氧化反应,电极反应式为SO2-2e-+2H2O![]() 4H++SO42-,通入O2的一极发生还原反应,电极反应式为O2+4H++4e-
4H++SO42-,通入O2的一极发生还原反应,电极反应式为O2+4H++4e-![]() 2H2O。分析装置B,N2O5是由N2O4氧化而来,则在阳极生成,电解池中与外电源正极相连的作阳极,由此得c 极区生成N2O5。换个角度思考:N2O5是硝酸的酸酐,极易和水反应,也不可能在d极区生成。在写电极反应式时,要注意此处HNO3是无水硝酸,溶液中不存在H+和NO3- ,所以在电极反应式中应保留其化学式,电极反应式表示为N2O4+2HNO3-2e-
2H2O。分析装置B,N2O5是由N2O4氧化而来,则在阳极生成,电解池中与外电源正极相连的作阳极,由此得c 极区生成N2O5。换个角度思考:N2O5是硝酸的酸酐,极易和水反应,也不可能在d极区生成。在写电极反应式时,要注意此处HNO3是无水硝酸,溶液中不存在H+和NO3- ,所以在电极反应式中应保留其化学式,电极反应式表示为N2O4+2HNO3-2e-![]() 2N2O5+2H+。⑷根据电极反应式SO2-2e-+2H2O
2N2O5+2H+。⑷根据电极反应式SO2-2e-+2H2O![]() 4H++SO42-可知:要使硫酸溶液的浓度维持不变,需要水的量由两部分组成,一是反应消耗的水,二是稀释用的水,每分钟通入SO20.1mol,反应消耗水0.2mol,生成H2SO40.1mol,根据原H2SO4的浓度(50%)知需要稀释用水9.8g,因此共需水9.8g+3.6g
4H++SO42-可知:要使硫酸溶液的浓度维持不变,需要水的量由两部分组成,一是反应消耗的水,二是稀释用的水,每分钟通入SO20.1mol,反应消耗水0.2mol,生成H2SO40.1mol,根据原H2SO4的浓度(50%)知需要稀释用水9.8g,因此共需水9.8g+3.6g![]() 13.4g。
13.4g。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com