
已知:H2(g)+I2(g)2HI(g) ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
( )
A.甲、乙提高相同温度
B.甲中加入0.1 mol He,乙不变
C.甲降低温度,乙不变
D.甲增加0.1 mol H2,乙增加0.1 mol I2
科目:高中化学 来源: 题型:
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)====CO(g)+3H2(g) ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)====2CO(g)+2H2(g) ΔH=247.4 kJ·mol-1
2H2S(g)====2H2(g)+S2(g) ΔH=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为_______________________。
(2)H2S热分解制氢时,常向反应器中通入一定比例的空气,使部分H2S燃烧,其目的是___________________________ _______________________________;
_______________________________;
燃烧生成的SO2与H2S进一步反应,生成物在常温下均不是气体,写出该反应的化学方程式:_______________________________________。
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图a所示。图中A、B表示的物质依次是________________________。
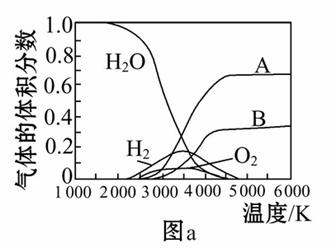
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下取0.2 mol·L-1的盐酸与0.2 mol·L-1的MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6。试回答下列问题:
(1)混合溶液中由水电离出的[H+]____ (填“>”“<”或“=”)0.2 mol·L-1盐 酸中水电离出的[H+]。
酸中水电离出的[H+]。
(2)求混合溶液中下列计算式的精确结果:
[Cl-]-[M+]=_________mol·L-1,[H+]-[MOH]=_________mol·L-1(填具体数字)。
(3)若室温下取0.2 mol·L-1的MOH溶液与0.1 mol·L-1的盐酸等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度__________ (填“>”“<”或“=”)MCl的水解程度,溶液中各离子浓度由大到小的顺序为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
标准生成热指的是在某温度下,由处于标准状态的各种元素的最稳定的单质生成标准状态下1 mol某纯物质的热效应,单位常用kJ·mol-1表示。已知在25℃的条件下:
Ag2O(s)+2HCl(g)===2AgCl(s)+H2O(l) ΔH1=-324.4 kJ·mol-1
2Ag(s)+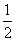 O2(g)===Ag2O(s) ΔH2=-30.56 kJ·mol-1
O2(g)===Ag2O(s) ΔH2=-30.56 kJ·mol-1
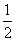 H2(g)+
H2(g)+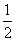 Cl2(g)===HCl(g) ΔH3=-92.21 kJ·mol-1
Cl2(g)===HCl(g) ΔH3=-92.21 kJ·mol-1
H2(g)+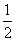 O2(g)===H2O(l) ΔH4=-285.6 kJ·mol-1
O2(g)===H2O(l) ΔH4=-285.6 kJ·mol-1
则25℃时氯化银的标准生成热为( )
A.-126.89 kJ·mol-1 B.-324.4 kJ·mol-1
C.-30.56 kJ·mol-1 D.题中数据不足,无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:NaHCO3在水溶液中水解的热化学方程式为:NaHCO3(aq)+H2O(l)===H2CO3(aq)+NaOH(aq) ΔH=a kJ·mol-1;稀盐酸和稀NaOH的中和热为b kJ·mol-1。则等物质的量的NaHCO3(aq)与稀HCl(aq)反应的ΔH等于
( )
A.(a+b) kJ·mol-1 B.(a-b) kJ·mol-1
C.-(a-b) kJ·mol-1 D.-(a+b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在体积为2 L的密闭容器中,充入1 mol 气体A和a mol气体B,发生如下反应:A(g)+B(g)2C(g)。5 min 后反应达到平衡时n(A)为0.4 mol。在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如图所示。下列叙述正确的是(双选)( )
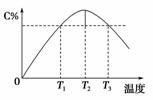
A.0~5 min,C物质的平均反应速率为0.12 mol·L-1·min-1
B.图中T1时正反应速率等于T3时正反应速率
C.该反应T2时的平衡常数大于T3时的平衡常数
D.图中T2时,若只增大压强,则正、逆反应速率不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg5种金属中的一种.已知:
(1)a、c均能与稀硫酸反应放出气体;
(2)b与d的硝酸盐反应,置换出单质d;
(3)c与强碱反应放出气体;
(4)c、e在冷浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为( )
|
| A. | Fe Cu Al Ag Mg |
|
| B. | Al Cu Mg Ag Fe |
|
| C. | Mg Cu Al Ag Fe |
|
| D. | Mg Ag Al Cu Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关氧化还原反应的判断中正确的是( )
|
| A. | 金属单质与盐溶液不一定发生置换反应 |
|
| B. | 侯氏制碱法的原理属于氧化还原反应 |
|
| C. | 阳离子只有氧化性,阴离子只有还原性 |
|
| D. | 失电子的数目越多,说明该物质的还原性越强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com