
����Ŀ��ij�����A������KAl��SO4��2��Al2O3��Fe2O3 �� ��һ�������¿�ʵ����ͼ��ʾ������֮��ı仯��
�ݴ˻ش��������⣺
��1�����IJ��ж�����Һ�ͳ����ķ����ȡ�ķ����� ��
��2������������ͼ��Ӧ��ϵ��д������B��D��E�������ʵĻ�ѧʽ
����B������D����ҺE�� _��
��3��д���١��ڡ���������Ӧ�����ӷ���ʽ���������ӷ�Ӧ��д���仯ѧ����ʽ��
���������� ��
���𰸡�
��1������
��2��Al2O3��Fe2O3��K2SO4����NH4��2SO4��NH3��H2O
��3��Al2O3+2OH��=2AlO2��+H2O��Al3++3NH3 �� H2O=Al��OH��3��+3NH4+��2Al��OH��3 ![]() Al2O3+3H2O
Al2O3+3H2O
���������⣺�����̿�֪��Al2O3��Fe2O3������ˮ�������CΪAl2O3��Fe2O3 �� ����������Ӧ�������DΪFe2O3 �� ��Ӧ�ڢ������ɵij���ΪAl��OH��3 �� ���ȷֽ�����BΪAl2O3 �� ��Ӧ��ΪKAl��SO4��2����ˮ�ķ�Ӧ������ҺEΪK2SO4����NH4��2SO4��NH3��H2O����1�������IJ��ж�����Һ�ͳ����ķ��뷽��Ϊ���ˣ����Դ��ǣ����ˣ���2��������������֪��BΪAl2O3 �� DΪFe2O3 �� EΪK2SO4����NH4��2SO4��NH3��H2O�����Դ��ǣ�Al2O3��Fe2O3��K2SO4����NH4��2SO4��NH3 �� H2O����3����Ӧ��ΪAl2O3+2OH��=2AlO2��+H2O����Ӧ��ΪAl3++3NH3 �� H2O=Al��OH��3��+3NH4+ �� ��Ӧ��Ϊ2Al��OH��3 ![]() Al2O3+3H2O�����Դ��ǣ�Al2O3+2OH��=2AlO2��+H2O��Al3++3NH3��H2O=Al��OH��3��+3NH4+��2Al��OH��3
Al2O3+3H2O�����Դ��ǣ�Al2O3+2OH��=2AlO2��+H2O��Al3++3NH3��H2O=Al��OH��3��+3NH4+��2Al��OH��3 ![]() Al2O3+3H2O��
Al2O3+3H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W����A��B����Ԫ����ɵ�AB2�ͻ����
��1����W�������������������ṹʽΪ��
��2����W�ͽ�̿�ڸ����·�����Ӧ�����Ƶõİ뵼�����Ӧ�ù㷺���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3����W�����ӻ���������������Ӿ���18�����ӣ�
�ٵ����������Ӹ�����Ϊ2��1ʱW�ĵ���ʽΪ��
�ڵ����������Ӹ�����Ϊ1��1ʱ�����ӵĵ���ʽΪ
��4����A��B��ͬ����Ԫ�أ�W����ˮ����һ�ֶ�Ԫ���ᣮ
����A��BΪ��������ʱB��Ԫ�����ڱ��е�λ��Ϊ �� W��ˮ��Һ��˫��ˮ�����Ļ�ѧ����ʽΪ ��
�����AԪ�ص�����������BԪ�ص�������A������������Ӧˮ����ķ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ⱥ��ʳ��ˮ������Һ�����ѭ��ʹ�ú�ClO����ClO3-���������ӡ�
��֪����.NaHCO3����50����ʼ�ֽ⣬����Һ�зֽ��¶ȸ��͡�
��.���������£�ClO����ǿ�����ԣ�ClO3-�����ȶ���
��.���������£�ClO3-��Fe2+��ԭΪCl����MnO4-��Fe2+��ԭΪMn2+��
��1�������β�����ԭ��ɱ�ʾΪ3ClO��![]() 2Cl��+ClO3-���÷�Ӧ��ƽ�ⳣ������ʽΪ ��
2Cl��+ClO3-���÷�Ӧ��ƽ�ⳣ������ʽΪ ��
��2���ⶨ�����ˮ��ClO3-������ʵ�����£�
����1����ȡ��ˮ��ƷV mL������pH��9~10����ϡ����500 mL��
����2��ȡ10.00 mLϡ�ͺ����Һ���μ�5%��˫��ˮ�������ٲ������ݡ�
����3�����뱥��NaHCO3��Һ20 mL����С�
����4����ȴ��������ϡ�����ữ��
����5������a mol��L-1FeSO4��ҺV1 mL��������������ͼ��ʾװ����С�

����6����ȴ����c mol��L-1KMnO4����Һ�ζ����յ㣬����KMnO4����ҺV2mL��
��ϡ��ʱ�õ��IJ����������ձ�����ͷ�ιܡ� ��
������2��˫��ˮ��ȥ��ˮ�в���ClO�������ӷ���ʽΪ ����ԭ������Na2SO3��ԭ��Ϊ ��
���벽��5��ͨN2Ŀ����ͬ��ʵ���� ����д����ţ���
������ˮ������ClO3-��Ũ��Ϊ mol��L-1���ú���ĸ�Ĵ���ʽ��ʾ����
��Ϊ���ʵ�����ľ�ȷ�ȣ����貹���ʵ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����MnO2��FeSO4��Һ�������ַ�Ӧ����ˣ�����Һ������60�����ټ���Na2CO3��Һ�����տ��Ƶü�ʽ̼����[aMnCO3��bMn(OH)2��cH2O]��
��1���÷���м�����ᷴӦ�Ʊ�FeSO4��Һʱ��������м�������ֵ�Ըߣ�ԭ���� ����Ӧǰ�轫����м����Na2CO3��Һ���ݣ���Ŀ���� ��
��2��Ϊ�ⶨ��ʽ̼������ɣ�ȡ7.390 g��Ʒ�������ᣬ����CO2 224.0 mL����״�����������500 mL��Һ��ȷ��ȡ10.00 mL����Һ����0.0500 mol��L-1 EDTA����ѧʽNa2H2Y������Һ�ζ����е�Mn2+��ԭ��ΪMn2+ +H2Y2��=MnY2��+2H+�������յ�ʱ����EDTA����Һ28.00 mL��ͨ������ȷ������Ʒ�Ļ�ѧʽ����д��������̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��A��B��C��D���ֶ�����Ԫ�أ�A��Dԭ������֮�͵���B��C��ԭ������֮�ͣ���DԪ����ɵĵ�����ͨ��״���³ʻ���ɫ��B��C��D����Ԫ��λ��ͬһ���ڣ�A��B��C����Ԫ�ص�����������Ӧ��ˮ����ֱ�ΪX��Y��Z���Ҵ�������ת����ϵ����֪Z�dz�������������������ƶϻش��������⣮ 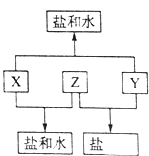
��1��DԪ��ԭ�ӵĽṹʾ��ͼΪ��
��2��A��B��C����Ԫ�ص�ԭ�Ӱ뾶��С�����˳��Ϊ����Ԫ�ط��ű�ʾ����
��3��Y��CԪ�ص������������Է�����Ӧ���÷�Ӧ�����ӷ���ʽΪ��
��4��ʵ�����У�Ӧ��X��Ũ��Һ��������ɫ�Լ�ƿ�У���ԭ�������û�ѧ����ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������밲ȫ�йص�˵����ȷ����
A. �������������Ԫ�أ�����Ҫ��Ը����ߵ����ʳ��
B. ��ȼ�Լ���ǿ�������Լ��ֿ����ò�Զ���Դ
C. ŨH2SO4����Ƥ���ϣ�������̼����ϡ��Һϴ��
D. ��������Ũ��Һ�������У�Ӧ�����ô���ˮ��ϴ������ϡ�����ϴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڵ�3�����У��û��������������ǿ��Ԫ�ص�Ԫ�ط���Ϊ �� ��ѧ�������ȶ���Ԫ�ط����� �� ����������ˮ�����������ǿ�Ļ�����Ļ�ѧʽ�� �� ����������ˮ����ļ�����ǿ�Ļ�����Ļ�ѧʽ�� �� �����Ե���������Ļ�ѧʽ�� �� �������������������ᡢ����������Һ�ֱ�Ӧ�����ӷ���ʽΪ�� �� ԭ�Ӱ뾶���Ľ���Ԫ�ص������� �� ���Ӱ뾶��С�����ӽṹʾ��ͼ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼ�ϵ���ͺ����ƾ������Ǿ����ȶ��Ժã����ȸߣ��������Ժõ��ŵ㣬��ר��Ϊ������Ƶ�һ��ִ���ļ��ߣ���ͼ��ʾ��һ������ȼ�ϵ�ؾƾ�����ǵ�ʾ��ͼ������˵��������ǣ� ��
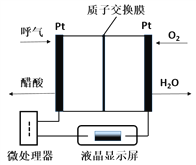
A. �õ�صĸ�����ӦʽΪ��CH3CH2OH-4e-+H2O=CH3COOH+4H+
B. ����·����0.4mol����ת��ʱ������3.2gO2
C. ��ع���ʱH+��������ͨ�����ӽ���Ĥ
D. ������ͨ����������С�ɼ�������������оƾ��ĺ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com