
主要实验步骤:①准确称取工业纯碱试样2.00 g;②用适量水配制成体积一定的溶液;③准确称取一定量的所配试液,再用0.01 mol·L-1盐酸标准滴定,测其总碱度。请回答以下问题:
(1)称取固体工业纯碱试样时,为什么试样取量尽量多些并且力求均匀?
____________________________________。
(2)在准确称取纯碱试样后,为继续进行实验,除选用烧杯、玻璃棒、酸式滴定管、碱式滴定管、锥形瓶之外,还需要的仪器用品(试剂除外)有___________ 。
(3)在滴定操作中,应选用的指示剂是___________。
(4)假如所称取的纯碱试样中,除含有2%的NaCl外,另外的杂质中只有NaHCO3,那么NaHCO3含量的大小对该试样总碱度的测定值有何影响?
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
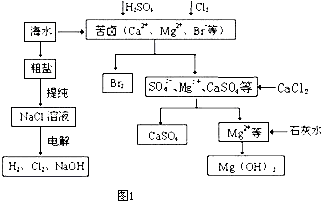
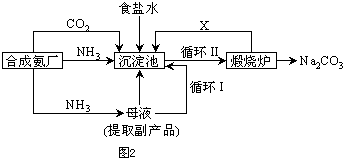
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题

 NaCl(l)+ K(g)。工业上应采用哪些措施才能使反应向正反应方向移动?___________________
NaCl(l)+ K(g)。工业上应采用哪些措施才能使反应向正反应方向移动?___________________ 查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
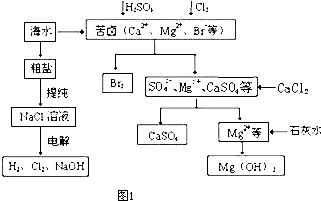
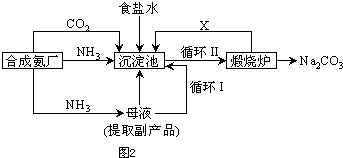
查看答案和解析>>
科目:高中化学 来源:2012-2013学年重庆市垫江实验中学高二(上)期中化学试卷(解析版) 题型:解答题


 CO2+H2
CO2+H2查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com