【答案】
分析:(1)反应生成是碳酸钡沉淀,沉淀会附着氯化钠、氯化钡等物质,检验最后的滤液中是否含有钡离子或氯离子即可;
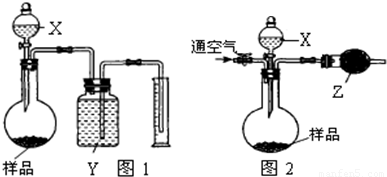
(2)甲同学利用X与样品反应生成二氧化碳,通过测定二氧化碳的体积计算样品中碳酸钠的质量,进而计算纯度.乙同学利用X与样品反应生成二氧化碳,将生成的二氧化碳从装置中完全排出,通过反应前后整套装置的质量差,测定二氧化碳的质量,计算样品中碳酸钠的质量,进而计算纯度;
故使用的试剂X不能具有挥发性,否则会影响乙同学方案中二氧化碳质量的测定,导致测定二氧化碳的质量偏大,故试剂X应选择稀硫酸;图2中干燥管是吸收二氧化碳中的水蒸气,防止影响二氧化碳质量的测定,故应固体Z具有吸水性,且不能吸收二氧化碳;图1中利用排液体法测定二氧化碳的体积,故试剂Y不能溶解二氧化碳,故可以选择饱和的碳酸氢钠;
图1装置反应后烧瓶中总会留有CO
2,二氧化碳排出空气,占有原来空气的体积,不影响测出的CO
2的体积;
图2装置中若没有通空气的操作,二氧化碳部分残留在装置内,二氧化碳排出空气,占有原来空气的体积,但二氧化碳的摩尔质量比空气大,导致排出气体的质量减小,即测定二氧化碳的质量偏小;
(3)V
1 mL溶液中加过量的BaCl
2溶液和几滴酚酞,再用标准盐酸(浓度用c(HCl)表示)滴定,滴定反应为OH
-+H
+=H
2O,
消耗盐酸的物质的量为c(HCl)×V
2×10
-3mol,故V
1 mL溶液中n(NaOH)=c(HCl)×V
2×10
-3mol,m g样品中含有氢氧化钠为
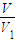
×c(HCl)×V
2×10
-3mol,据此计算mg样品中氢氧化钠的质量,根据纯度定义计算.
解答:解:(1)反应生成是碳酸钡沉淀,沉淀会附着氯化钠、氯化钡等物质,检验最后的滤液中是否含有钡离子或氯离子即可,检验方法是:取最后的滤液少许与试管内,滴加硝酸银溶液,若无白色沉淀生成,说明洗涤干净.(或取最后的滤液少许与试管内,滴加硫酸钠溶液,若无白色沉淀生成,说明洗涤干净),
故答案为:取最后的滤液少许与试管内,滴加硝酸银溶液,若无白色沉淀生成,说明洗涤干净.(或取最后的滤液少许与试管内,滴加硫酸钠溶液,若无白色沉淀生成,说明洗涤干净);
(2)甲同学利用X与样品反应生成二氧化碳,通过测定二氧化碳的体积计算样品中碳酸钠的质量,进而计算纯度.乙同学利用X与样品反应生成二氧化碳,将生成的二氧化碳从装置中完全排出,通过反应前后整套装置的质量差,测定二氧化碳的质量,计算样品中碳酸钠的质量,进而计算纯度.
故使用的试剂X不能具有挥发性,否则会影响乙同学方案中二氧化碳质量的测定,导致测定二氧化碳的质量偏大,故试剂X应选择稀硫酸;图2中干燥管是吸收二氧化碳中的水蒸气,防止影响二氧化碳质量的测定,故应固体Z具有吸水性,且不能吸收二氧化碳,故Z以选用无水CaCl
2,图1中利用排液体法测定二氧化碳的体积,故试剂Y不能溶解二氧化碳,故可以选择饱和的碳酸氢钠溶液;
图1装置反应后烧瓶中总会留有CO
2,二氧化碳排出空气,占有原来空气的体积,不影响测出的CO
2的体积;
图2装置中若没有通空气的操作,二氧化碳部分残留在装置内,二氧化碳排出空气,占有原来空气的体积,但二氧化碳的摩尔质量比空气大,导致排出气体的质量减小,即测定二氧化碳的质量偏小,计算碳酸钠的质量偏小,氢氧化钠的纯度偏高,
故答案为:稀硫酸;饱和的碳酸氢钠溶液;无水CaCl
2;否;偏高;
(3)V
1 mL溶液中加过量的BaCl
2溶液和几滴酚酞,再用标准盐酸(浓度用c(HCl)表示)滴定,滴定反应为OH
-+H
+=H
2O,
消耗盐酸的物质的量为c(HCl)×V
2×10
-3mol,故V
1 mL溶液中n(NaOH)=c(HCl)×V
2×10
-3mol,m g样品中含有氢氧化钠为
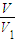
×c(HCl)×V
2×10
-3mol,mg样品中氢氧化钠的质量为
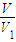
×c(HCl)×V
2×10
-3mol×40g/mol=

×c(HCl)×V
2×10
-3×40g,故样品中氢氧化钠纯度为
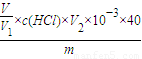
×100%,
故答案为:
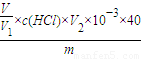
×100%.
点评:本题考查学生对实验原理及装置理解、对操作的评价、物质含量的测定、中和滴定、化学计算等,难度中等,清楚实验原理是解题的关键,是对所学知识的综合运用,需要学生具备扎实的基础与运用知识分析问题解决问题的能力.

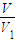 ×c(HCl)×V2×10-3mol,据此计算mg样品中氢氧化钠的质量,根据纯度定义计算.
×c(HCl)×V2×10-3mol,据此计算mg样品中氢氧化钠的质量,根据纯度定义计算.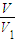 ×c(HCl)×V2×10-3mol,mg样品中氢氧化钠的质量为
×c(HCl)×V2×10-3mol,mg样品中氢氧化钠的质量为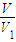 ×c(HCl)×V2×10-3mol×40g/mol=
×c(HCl)×V2×10-3mol×40g/mol= ×c(HCl)×V2×10-3×40g,故样品中氢氧化钠纯度为
×c(HCl)×V2×10-3×40g,故样品中氢氧化钠纯度为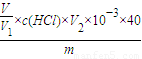 ×100%,
×100%,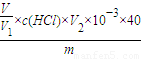 ×100%.
×100%.






