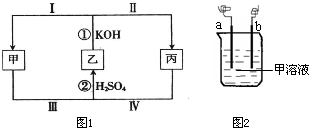
解:(1)
①若乙为Cl
2,丙为KClO,由Cl从0价→+1价,由甲、乙、丙三种物质中含有同一种元素可知,甲中的Cl化合价变化应降低.发生反应:Cl
2+2KOH═KCl+KClO+H
2O.
故答案为:KCl;
②反应②中甲为KCl,丙为KClO,H
2SO
4作介质,根据氧化还原反应中的价态归中的反应规律.
故答案为:KClO+KCl+H
2SO
4═K
2SO
4+Cl
2↑+H
2O;
③若将反应①设计成原电池,正极反应应为化合价降低的反应.Ⅰ中乙为Cl
2,甲为KCl,Cl从0价→-1价.
故答案为:Ⅰ;
④如图2所示,a、b两电极材料分别为铁钉和石墨
A.a 电极可作阳极,铁钉失去电子,发生氧化反应.故A错误;
B.a 电极可能发生反应:2H
++2e
-=H
2↑是指a 电极铁钉作阴极时发生还原反应.故B正确;
C.b 电极可能有气体放出,当b 电极石墨作阳极时发生反应:2KCl+2H
2O

2KOH+H
2↑+Cl
2↑b 电极产生Cl
2↑故C错误;
D.a电极可能发生反应:Fe-2e
-=Fe
2+是指a 电极铁钉作阳极时的反应.故D正确;
故答案为A、C;
(2)
设甲、丙中X的物质的量分别为m、n,则由氧化还原反应规律氧化剂得到的电子总数等于还原剂失去的电子总数.知:(b-a)×m=(c-b)×n.解得n:m=(b-a)/(c-b)氧化剂发生还原反应对应产物为还原产物,还原剂发生氧化反应对应产物为氧化产物.则该反应中氧化产物与还原产物中X元素的物质的量之比为n:m=(b-a)/(c-b).
故答案为:
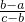
分析:(1)根据框图1:若乙为Cl
2,丙为KClO,应联想到氯气与碱溶液的反应.若将反应①设计成原电池,应考虑原电池的正极发生还原反应;
(2)应抓住氧化还原反应中氧化剂与还原剂间得失电子守恒解题.
点评:点评:本题考查了对元素化合物氯性质的掌握,考查了对氧化还原反应的理解及电化学相关知识.并要求具有作出合理解释的能力.要求能够从试题提供的信息中,准确地提取有价值的内容,本题目较为综合,难度大.


 2KOH+H2↑+Cl2↑b 电极产生Cl2↑故C错误;
2KOH+H2↑+Cl2↑b 电极产生Cl2↑故C错误;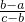


 53随堂测系列答案
53随堂测系列答案