

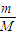 计算2.8gFe的物质的量,计算生成氢气的物质的量,根据V=nVm计算生成氢气的体积;
计算2.8gFe的物质的量,计算生成氢气的物质的量,根据V=nVm计算生成氢气的体积;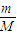 计算O2与HCl物质的量,相同条件下体积之比等于物质的量之比;
计算O2与HCl物质的量,相同条件下体积之比等于物质的量之比;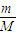 计算S02和S03的物质的量,再结合分子含有的原子数目计算原子的物质的量;
计算S02和S03的物质的量,再结合分子含有的原子数目计算原子的物质的量;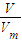 计算二氧化碳的物质的量,氧原子的物质的量等于二氧化碳的2倍,等于水的物质的量,根据m=nM计算水的质量;
计算二氧化碳的物质的量,氧原子的物质的量等于二氧化碳的2倍,等于水的物质的量,根据m=nM计算水的质量;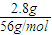 =0.05mo,发生反应Fe+2HCl=FeCl2+H2↑,由方程式可知,生成氢气的物质的量为0.05mol,故生成氢气的体积为0.05mol×22.4L/mol=1.12L,故答案为:1.12;
=0.05mo,发生反应Fe+2HCl=FeCl2+H2↑,由方程式可知,生成氢气的物质的量为0.05mol,故生成氢气的体积为0.05mol×22.4L/mol=1.12L,故答案为:1.12;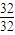 :
: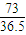 =1:2,相同条件下体积之比等于物质的量之比为1:2,故答案为:1:2;
=1:2,相同条件下体积之比等于物质的量之比为1:2,故答案为:1:2;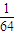 mol,S03的物质的量为
mol,S03的物质的量为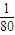 mol,故相同质量的S02和S03中所含原子个数比为:
mol,故相同质量的S02和S03中所含原子个数比为: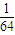 mol×3:
mol×3: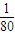 mol:4=15:16,故答案为:15:16;
mol:4=15:16,故答案为:15:16;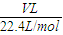 =
=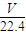 mol,氧原子的物质的量等于二氧化碳的2倍,氧原子物质的量为
mol,氧原子的物质的量等于二氧化碳的2倍,氧原子物质的量为 mol×2=
mol×2=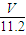 mol,含有相等氧原子的水的物质的量为
mol,含有相等氧原子的水的物质的量为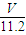 mol,故水的质量为
mol,故水的质量为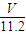 mol×18g/mol=
mol×18g/mol=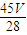 g,故答案为:
g,故答案为: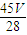 ;
;

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:阅读理解
 H++B(OH)4-,该反应中的碱是
H++B(OH)4-,该反应中的碱是查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解



| 高温 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (选做题)
(选做题)| 45V |
| 28 |
| 45V |
| 28 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
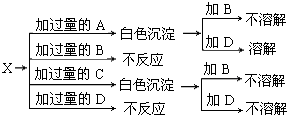
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com