
科目:高中化学 来源:不详 题型:填空题
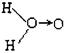 (式中O→O表示共用电子对由前一个氧原子提供)和 b.H—O—O—H
(式中O→O表示共用电子对由前一个氧原子提供)和 b.H—O—O—H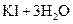

 试写出阳极的电极反应式 。
试写出阳极的电极反应式 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.还原剂 | B.氧化剂 |
| C.既是还原剂又是氧化剂 | D.既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用惰性电极电解MgCl2溶液:2Cl—+H2O通电 2OH—+Cl2↑+H2↑ |
B.碳酸钠溶液显碱性:CO32—+H2O HCO3—+OH— HCO3—+OH— |
C.氯气通入冷水中:Cl2 +H2O  Cl- +ClO- +2H+ Cl- +ClO- +2H+ |
| D.碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH= 2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.还原性强弱顺序为:Br—>Fe2+>Cl— |
| B.氧化性强弱顺序为:MnO4—>Cl2>Br2>Fe3+ |
| C.反应?中,当生成1molCl2时,被氧化的HCl为3.2mol |
| D.溶液中可发生反应:2Fe3+ + 2Cl—= 2Fe2+ + Cl2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2Fe3++SO2+2H2O=SO42-+4H++2Fe2+ | B.I2+SO2+2H2O=H2SO4+2HI |
| C.H2O2+2H++SO42-=SO2+O2+2H2O | D.2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com