
分析 Ⅰ、依据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式;
Ⅱ、(1)醋酸是弱电解质,加水稀释促进醋酸电离,如果加入少量冰醋酸,醋酸浓度增大平衡向右移动,向醋酸中加入醋酸钠固体,溶液中醋酸根离子浓度增大,抑制醋酸电离;
(2)氯化氢是强电解质,完全电离,醋酸是弱电解质,溶液中存在电离平衡,加水稀释促进醋酸电离,若将甲、乙两溶液等体积混合,溶液的pH=2;
(3)各取25mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积与酸的物质的量成正比.
解答 Ⅰ、稀的强酸与强碱溶液反应的中和热为57.3kJ/mol,则稀硫酸与稀烧碱溶液中和热的热化学方程式为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol,故答案为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3 kJ/mol;
Ⅱ、(1)醋酸是弱电解质,加水稀释促进醋酸电离,所以醋酸电离平衡向正反应方向移动;向醋酸中加入醋酸钠固体,溶液中醋酸根离子浓度增大,抑制醋酸电离,则氢离子浓度减小,醋酸分子浓度增大,所以c(H+)/c(CH3COOH)减小,故答案为:向右,向右,减小;
(2)氯化氢是强电解质,完全电离,醋酸是弱电解质,溶液中存在电离平衡,加水稀释促进醋酸电离,所以醋酸溶液中氢离子浓度减小程度大于盐酸溶液中氢离子浓度减小程度,所以盐酸的pH大于醋酸,混合前醋酸和HCl溶液的pH相等,若将甲、乙两溶液等体积混合,加水稀释形成醋酸电离,则溶液中氢离子浓度吧,所以溶液的pH=2,故答案为:小于,2;
(3)各取25mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积与酸的物质的量成正比,等pH、等体积的醋酸和HCl中n(CH3COOH)>n(HCl),所以消耗NaOH体积V(甲)大于V(乙),
故答案为:大于.
点评 本题考查了酸碱混合溶液定性判断,明确弱电解质电离特点及混合溶液酸碱性即可解答,会利用平衡原理解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下将0.1mol•L-1NH4Cl溶液与0.05mol•L-1NaOH溶液等体积混合:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 常温下物质的量浓度相等的①NH4HSO4②CH3COONH4③NH4Cl三种溶液中c(NH4+):①>③>② | |
| C. | 0.1mol•L-1的NaHA溶液,其pH=11,则溶液中:c(HA-)>c(OH-)>c(A2-)>c(H2A) | |
| D. | 在相同条件下,将足联AgCl加入等体积的①0.01mol•L-1 KCl②0.1mol•L-1 KCl溶液③蒸馏水三种液体中,所能溶解的AgCl质量关系为:①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
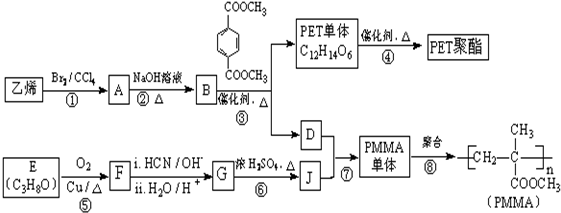
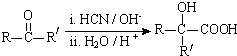 (R、R′代表烃基,可相同也可不同)
(R、R′代表烃基,可相同也可不同)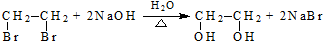 .
. .
.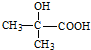 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(Na+)>2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | c(Na+)>c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 若c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),则可确定a>0.5 | |
| D. | 若c(CO32-)+2c(OH-)=2c(H+)+c(HCO3-)+3c (H2CO3),则可确定a=0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com