
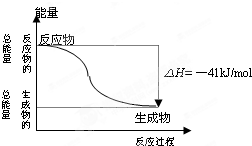
 已知一定条件下,CO(g)+H2O (g)=CO2(g)+H2(g)反应过程能量变化如图所示,下列有关该反应的说法正确的是( )
已知一定条件下,CO(g)+H2O (g)=CO2(g)+H2(g)反应过程能量变化如图所示,下列有关该反应的说法正确的是( )

 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
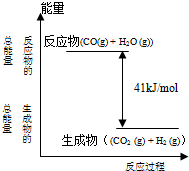 已知一定条件下,CO(g)+H2O (g)?CO2 (g)+H2 (g)反应过程能量变化如图所示,该反应为
已知一定条件下,CO(g)+H2O (g)?CO2 (g)+H2 (g)反应过程能量变化如图所示,该反应为查看答案和解析>>
科目:高中化学 来源: 题型:
(4分)已知一定条件下,CO(g) + H2O (g) CO2 (g)+ H2 (g)反应过程能量变化如右图所示,该反应为 反应(填“吸热”或“放热”),反应的热化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省宁波市高一下学期期末化学试卷 题型:填空题
(4分)已知一定条件下,CO(g) + H2O (g)  CO2 (g)+ H2 (g)反应过程能量变化如右图所示,该反应为 反应(填“吸热”或“放热”),反应的热化学方程式为: 。
CO2 (g)+ H2 (g)反应过程能量变化如右图所示,该反应为 反应(填“吸热”或“放热”),反应的热化学方程式为: 。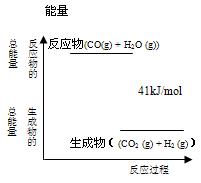
查看答案和解析>>
科目:高中化学 来源:2013届浙江省宁波市高一下学期期末化学试卷 题型:填空题
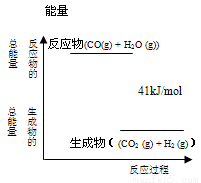
(4分)已知一定条件下,CO(g) + H2O (g)  CO2 (g)+ H2 (g)反应过程能量变化如右图所示,该反应为 反应(填“吸热”或“放热”),反应的热化学方程式为:
。
CO2 (g)+ H2 (g)反应过程能量变化如右图所示,该反应为 反应(填“吸热”或“放热”),反应的热化学方程式为:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com