
【题目】下列分类不正确的是
A.酸: HNO3、K2SO4、H2CO3B.碱:Cu(OH)2、NaOH、Ca(OH)2
C.盐:AgCl、BaSO4、Mg(NO3)2D.氧化物:FeO、SO2、CO
科目:高中化学 来源: 题型:
【题目】Ⅰ.消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:

b.①N2(g)+O2(g)===2NO(g) ΔH1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-565 kJ·mol-1
(1)ΔH1=________。
(2)在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式:_________。
Ⅱ. SO2、CO、NOx是对环境影响较大的气体,对它们的合理控制和治理是优化我们生存环境的有效途径。请回答下列问题:
(1)已知25℃、101 kPa时:
①2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1
2SO3(g) ΔH1=-197 kJ·mol-1
②H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1
③2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应的热化学方程式是______________________。
(2)若反应2H2(g)+O2(g)===2H2O(g)
ΔH=-241.8 kJ·mol-1,根据下表数据求x=_______kJ·mol-1。
化学键 | H—H | O=O | O—H |
断开1 mol化学 键所需的能量/kJ | 436 | x | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.氧化还原反应的特征是有元素化合价升降
B.氧化还原反应的本质是有电子转移
C.反应物所含元素的化合价升高,则发生了还原反应
D.氧化反应和还原反应一定同时发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.100mol/L 的AgNO3溶液滴定50.0mL,0.0500mol/L KCl溶液,以K2CrO4为指示剂,测得溶液中pCl=-lgc(Cl-) 、pAg=-lgc(Ag+)随加入AgNO3的体积变化如图所示,已知溶液中离子浓度小于等于1.0×10-5mol/L则沉淀完全,Ksp(Ag2CrO4)=2.0×10-12,Ksp(Ag2SO4)=1.4×10-5,下列说法错误的是( )
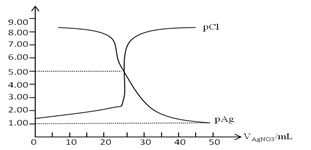
A. AgCl的沉淀溶解平衡常数Ksp数量级为10-10
B. 为防止指示剂失效,溶液应维持中性或弱碱性
C. 滴定中指示剂的有效浓度应维持在2.0×10-2 mol/L
D. 滴定完后加入1mL 0.01mol/L H2SO4会产生新的沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢一定条件下可发生分解:2H2O2(l)=2H2O(l)+O2(g),其能量变化如下图所示,下列说法正确的是

A.该分解反应为吸热反应
B.2molH2O2具有的能量小于2molH2O和1molO2所具有的总能量
C.加入MnO2或FeCl3均可提高该分解反应的速率
D.其他条件相同时,H2O2溶液的浓度越大,其分解速率越慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“墙角数枝梅,凌寒独自开.遥知不是雪,为有暗香来.”诗人在远处能闻到梅花香味的原因是( )
A.分子很小
B.分子是可分的
C.分子之间有间隔
D.分子不停地运动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中的成盐元素除了氯之外,还有溴和碘。
(1)工业上可用Cl2和NH4Cl溶液反应制取NCl3(NCl3既可用于漂白,又可用于柠檬等水果的熏蒸处理)。当用干燥洁净的玻璃棒蘸取NCl3滴到干燥的红色石蕊试纸上,试纸不褪色;若取NCl3滴入50-60oC热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,则试纸先变蓝后褪色。写出对应该现象的化学方程式:____________________________________________________。
(2)①碘酸钾与碘化钾在酸性条件下发生如下反应,配平该反应的化学方程式:______KIO3+ ______KI + H2SO4 = ______K2SO4+_____I2+ ______
②上述反应生成的I2可用四氯化碳检验,现象为________________________________________。
(3)NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6 mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
粒子 | I2 | Br2 | IO3- |
物质的量物的/mol | 0.5 | 1.3 | x |
则x= ______;原溶液中NaI的物质的量为______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com