
����Ŀ�������й�˵����ȷ���� �� ��
A.��״���£�2.24 L Cl2��������NaOH��Һ��Ӧ��ת�Ƶĵ�����ĿΪ0.1NA
B.��ӦNH3(g)+HCl(g)��NH4Cl(s)�������¿��Է����У���÷�Ӧ�Ħ�H��0
C.��ҵ����Ҫ��BaSO4����ת��ΪBaCO3 ������Ȼ����Ba2+ �� ������ΪKsp(BaSO4)��Ksp(BaCO3)��
D.��֪I ![]() I2��I�� �� ��ʢ��KI3��Һ���Թ��м�������CCl4 �� ���ú�CCl4������ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ�
I2��I�� �� ��ʢ��KI3��Һ���Թ��м�������CCl4 �� ���ú�CCl4������ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ�
���𰸡�A
���������⣺A����״����22.4LCl2��������NaOH��Һ��Ӧ��������ʹ����ᣬת�Ƶĵ�����ĿӦΪ0.1NA��ȷ��B���÷�Ӧ�ʱ�С���㣬���Է������ʱ�һ��С���㣬����C�������ø�Ũ�ȵ�̼������Һʹ��Һ�б����Ӻ�̼�������Ũ�Ȼ�����Ksp(BaCO3)������ʹBaSO4����ת��ΪBaCO3����������D�����ú�CCl4������ɫ�������ڵⵥ�����������Ȼ�̼����˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ���
��ѡA��
�����㾫����������Ҫ���������ӻ����������֪ʶ�㣬��Ҫ����ˮ�����ӻ�Kw=c(H+)��c(OH�C)=10�C14��25�棩��Kwֻ���¶��йأ��¶����ߣ�Kw�����磺100�� Kw=10�C12��Kw�����ڴ�ˮ��ϡ�ᡢϡ�ϡ��ˮ��Һ��������ȷ�����⣮


 Ӧ�����������Ĵ���ѧ������ϵ�д�
Ӧ�����������Ĵ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��MnO2��һ����Ҫ�������ܲ��ϣ���ҵ�ϴ��̽������ȡ������MnO2����������ͼ��ʾ�� 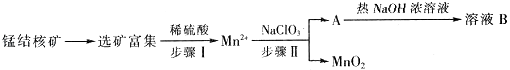
�������ܵĵ�����ܶȻ�������Ksp�����±���
������ | Zn��OH��2 | Fe��OH��2 | Fe��OH��3 |
Ksp����ֵ | 10��17 | 10��17 | 10��39 |
��֪��һ�������£�MnO4������Mn2+��Ӧ����MnO2
��1�������������0.5molMn2+ʱ����ȥ1molL��1��NaClO3��Һ200ml���÷�Ӧ���ӷ���ʽΪ ��
��2����֪��ҺB������֮һ��ѭ���������������������ʵ������� ��
��3��MnO2�Ǽ���п�̵�ص��������ϣ��ŵ���̲���MnOOH���õ�������ĵ缫��Ӧʽ�� �� ���ά�ֵ���ǿ��Ϊ5A����ع�������ӣ���������пg������֪F=96500C/mol��
��4����Ͼ�п�̵���ڵĻ�����Ҫ�ɷ�MnOOH��Zn��OH��2���м���һ������ϡ�����ϡ���ᣨH2C2O4���������Ͻ�������CO2����Ϊֹ��д��MnOOH���뷴Ӧ�����ӷ���ʽ �� ��������Һ�еμӸ��������Һ������ɫ���������ʵ��֤����ɫ�����ɷ�ΪMnO2
��5���÷ϵ�ص�пƤ����ZnSO47H2O�Ĺ����У����ȥпƤ�е��������������䷽���ǣ�����ϡH2SO4��H2O2 �� ���ܽ��ΪFe3+ �� �Ӽ����pHΪʱ�����պó�����ȫ������Ũ��С��1��10��5molL��1ʱ��������Ϊ�����ӳ�����ȫ���������Ӽ����pHΪʱ��п��ʼ�������ٶ�Zn2+Ũ��Ϊ0.1molL��1�������������̲���H2O2 �� ������ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ������������������Ų���ȫ��ͬ�����仯ѧ����һ����ͬ
B. ����ԭ���γɵ����ӣ�һ������ϡ������Ԫ��ԭ�ӵĺ�������Ų�
C. ��ԭ�ӣ������������Ų���ͬ����һ������ͬ��Ԫ��
D. ֻ����ԭ���У����������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӡ��ϰ�һ�š������д��̳��������������������IJ������ڣ� ��
A.��������
B.���ǽ�������
C.�ϳɸ߷��Ӳ���
D.��Ȼ�߷��Ӳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A. ˮ������������ˮ�ࡢ�մɾ�Ϊ�����
B. CO2��SiO2��CO������������
C. SiC�������н��ɰ��Ӳ�Ⱥܴ�
D. ʵ���������ռ�ʱ������ʹ��ʯӢ����������ʹ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���ʵ��������������ó��Ľ�����ȷ���ǣ� ��
ѡ�� | ʵ����������� | ���� |
A | ��FeBr2��Һ��ͨ������Cl2 �� ��Һ��dz��ɫ��Ϊ��ɫ | Cl2������ǿ��Br2 |
B | �����£������pH��3��HA��HB������ֱ��ˮϡ�ͣ���Һ����������ͼ | HA���Ա�HB�� |
C | ����ˮ�Ҵ��м���ŨH2SO4 �� ���ȣ�������������ͨ������KMnO4��Һ���Ϻ�ɫ��ȥ | ��Ӧ������ϩ |
D | ȡ���õ�Na2O2��ĩ�������еμӹ��������ᣬ������ɫ���� | ����Ϊ���� |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������֮��ķ�Ӧû�����Է�Ӧ������ǣ� ��
A. ��CO2ͨ�����ᱵ��
B. �ò������ֱ�պȡŨ�����Ũ��ˮ�������
C. ��������Һ��ͨ�������̼
D. ���Ȼ�������ͨ����з�̪���ռ���Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����������ȷ���ǣ� ��
A.��ʪ���pH��ֽ��ϡ��Һ��pH���ⶨֵƫ��
B.������ƿ������Һ������ʱ���ӿ̶��ߣ�������ҺŨ��ƫС
C.�ζ�ǰ�ζ����������ݣ��յ����ʱ�����ݣ��������ƫС
D.�ⶨ�кͷ�Ӧ����Ӧ��ʱ��������������У������¶�ֵƫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����Ҫ����һ�����յĺ�ͭ�������쵨����CuSO45H2O�����÷����и��ֳɷݺ������£�Cu��CuOԼռ87%������ΪMg��Al��Fe��Si��������������������������ʣ���������Ϊ�� 
���ֽ���������������������ʽ��ȫ����ʱ��Һ��pH�����
������ | Al��OH��3 | Fe��OH��3 | Cu��OH��2 | Mg��OH��2 | Fe��OH��2 |
pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
��ش��������⣺
��1���������ΪʲôҪ����ͭ������ĥ�ɷ�״�� ��
��2��������е����ӷ���ʽ��д��2�����ɣ����� ��
��3���������H2O2�μӷ�Ӧ�����ӷ���ʽ�� ��
��4��������е�����ҺpHʱ���˵�������������ţ���
A��NaOH B����ˮ C��Cu2��OH��2CO3 D��Cu��OH��2 E��MgCO3
��5������������������pH=2��3��ԭ���� ��
��6�������ķ��뷽�������� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com