
| A. | 摩尔是国际单位制中的七个基本物理量之一 | |
| B. | 1molO2中约含有6.02×1023个O2 | |
| C. | 1mol任何物质都含有6.02×1023个原子 | |
| D. | 摩尔表示物质的量 |
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 除氦外的稀有气体原子的最外层电子数都是8 | |
| D. | 同一元素的各种同位素的化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加碘盐的溶液遇淀粉变蓝 | |
| B. | 汽油和柴油均为石油分馏得到的产品 | |
| C. | CaCO3可用作工业废气的脱硫剂 | |
| D. | 蔗糖、淀粉、蛋白质溶于水均能形成胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | B. | CH2=CH2+H2$→_{△}^{催化剂}$CH3-CH3 | ||
| C. |  +3H2$→_{△}^{Ni}$ +3H2$→_{△}^{Ni}$ | D. |  +HNO3(浓)$\stackrel{浓H_{2}SO_{4}}{→}$ +HNO3(浓)$\stackrel{浓H_{2}SO_{4}}{→}$ NO2+H2O NO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊. | 碳酸的酸性比苯酚的强 |
| B | 室温下,向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(Ba2S O4)<Ksp(Ca2S O4) |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色. | Fe2+的氧化性比I2的强 |
| D | 室温下,用PH试纸测得:0.1mol•L-1 Na2SO3溶液的PH约为10;0.1mol•L-1 NaHSO3溶液的PH约为5. | HSO3-结合H+的能力比SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
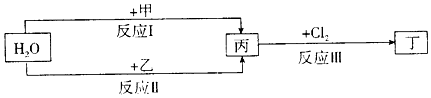
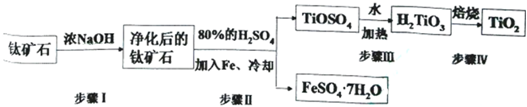
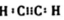 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向甲、乙两个容积均为1L的恒容容器中分别充入2mol A、2molB和1molA、l mol B.相同条件下发生如下反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法错误的是( )
向甲、乙两个容积均为1L的恒容容器中分别充入2mol A、2molB和1molA、l mol B.相同条件下发生如下反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示.下列说法错误的是( )| A. | x可能等于2也可能等于3 | |
| B. | 若向平衡后的乙容器中充入C,则再次达到平衡时A 的体积分数不变 | |
| C. | 单独升高甲容器的温度,可使甲容器中各物质的体积分数与乙容器相同 | |
| D. | 若其它条件不变,使乙容器体积变为2L,则平衡时乙容器中:0.25mol•L-1<c(A)<0.5mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com