
24Cr原子处于基态时,价电子排布可用电子排布图表示成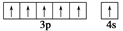 ,而不是
,而不是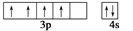 。下列说法中,正确的是()
。下列说法中,正确的是()
A. 这两种排布方式都符合能量最低原理
B. 这两种排布方式都符合泡利原理
C. 这两种排布方式都符合洪特规则
D. 这个实例说明洪特规则有时候和能量最低原理是矛盾的
科目:高中化学 来源:2017届湖南省长沙市高三上学期第二次周测化学试卷(解析版) 题型:填空题
锰及其化合物有广泛应用。
(1)在稀硫酸酸化的双氧水中加入二氧化锰粉末,产生大量气泡,且黑色固体消失;向反应完全后的溶液中加入高锰酸钾溶液生成黑色沉淀。经检测:1mol KMnO4完全反应转移3mol电子。在双氧水参与的反应中,二氧化锰除了作催化剂还作 ;写出加入高锰酸钾后产生黑色沉淀的离子方程式 。
(2)菱锰矿是生产铁锰合金中锰的来源,其主要成分是碳酸锰。已知锰常见的化合价有+2、+4、+6、+7。在空气中灼烧菱锰矿生产四氧化三锰,然后用铝热反应制备锰。写出菱锰矿粉末在空气中高温灼烧生成四氧化三锰的化学方程式 。如果冶炼1100kg锰,理论上消耗铝的质量为 kg。

(3)工业生产中为了制备硫酸锰,往往将硫酸锰溶液中亚铁离子氧化成铁离子,调节pH除去铁离子。向混合溶液中滴加稀硫酸酸化,加入软锰矿(主要成分是二氧化锰)氧化亚铁离子,写出该过程的离子方程式 。
(4)酸性高锰酸钾可氧化乙醇,配平下列反应方程式:
KMnO4+ H2SO4+ CH3CH2OH= K2SO4+ MnSO4+ CH3COOH+ □。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林长春第十一中高一下期末考化学(解析版) 题型:选择题
将BaO2放入密闭的真空容器中,反应2BaO2(s)  2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
A.平衡常数减小 B.BaO量不变 C.氧气压强不变 D.BaO2量不增加
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林长春第十一中高一下期末考化学(解析版) 题型:选择题
把下列四种X溶液分别加入四个盛有10mL 2molL﹣1盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应速率最快的是( )
A.10℃20mL3 molL﹣1的X溶液
B.20℃30 mL 2 molL﹣1的X溶液
C.20℃10 mL 4 molL﹣1的X溶液
D.10℃10 mL 2 molL﹣1的X溶液
查看答案和解析>>
科目:高中化学 来源:2017届河南信阳高考化学暑假自学自测专练:原子结构与性质(解析版) 题型:实验题
为测定该补血剂样品[主要成分是硫酸亚铁晶体(FeSO4·7H2O)]中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:用酸性KMnO4溶液滴定测定铁元素的含量
(1)写出滴定反应的离子方程式 .
(2)下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号).
(3)实验前,首先要准确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 (填仪器名称).
方案二 将FeSO4转化为Fe2O3,测定质量变化操作流程如下:
(4)步骤②中除用H2O2外还可以使用的物质是 .
(5)步骤②是否可以省略 ,理由是 .
(6)步骤④中一系列操作依次是:过滤、洗涤、 、冷却、称量.
(7)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示).
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一下学期期末化学试卷(解析版) 题型:推断题
以淀粉为主要原料合成一种具有果香味有机物C和高分子化合物E的合成路线如下图所示。
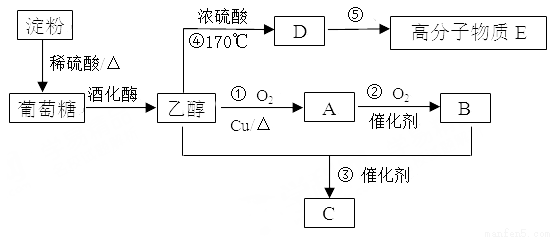
请回答下列问题:
(1)写出D的电子式 ,A分子内含有的官能团是 (填名称)。
(2)写出下列反应的反应类型:② ,④ 。
(3)写出下列反应的化学方程式:
① ;
⑤ 。
(4)某同学欲用下图装置制备物质C,将试管B中乙酸乙酯分离出来,用到的主要玻璃仪器有:烧杯、 ,插入试管B的导管接有一个球状物,其作用为
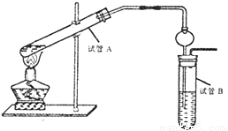
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一下学期期末化学试卷(解析版) 题型:选择题
某有机物的结构简式如下图,则此有机物可发生的反应有:( )
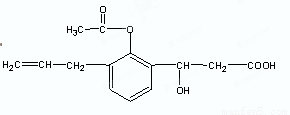
①取代 ②加成 ③氧化 ④酯化 ⑤水解 ⑥中和
A. ①②③⑤ B.②③④⑤ C .①②③④⑤ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省揭阳市高二期末统考理综化学试卷(解析版) 题型:填空题
研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。
I.污染物SO2、NOx经O2预处理后用CaSO3悬浊液吸收,可减少尾气中SO2、NOx的含量。T℃时,O2氧化烟气中SO2、NOx的主要反应的热化学方程式为:
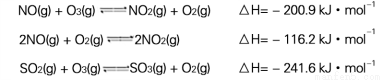
(1) T℃时,反应3NO(g)+O3(g) 3NO2(g)的△H= kJ·mol-1。
3NO2(g)的△H= kJ·mol-1。
(2) T℃时,将0.6 mol NO和0.2 molO3气体充入到2L固定容积的恒温密闭容器中,NO的浓度随反应时间的变化如图1所示。
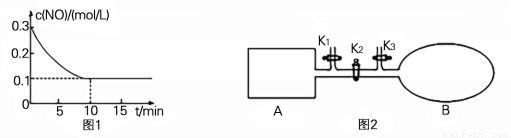
① T℃时,反应3NO(g) +O3 (g)  3NO2 (g)的平衡常数K= 。
3NO2 (g)的平衡常数K= 。
② 不能说明反应达到平衡状态的是 (填写字母)。
A.气体颜色不再改变 B.气体的平均摩尔质量不再改变
C.气体的密度不再改变 D.单位时间内生成O3和NO2物质的量之比为1∶3
II.NO2的二聚体N2O4是火箭中常用氧化剂。完成下列问题:
(3) 如图2所示,A是由导热材料制成的恒容密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 molNO2通过K1、K3分别充入真空A、B中,反应起始时A、B的体积相同均为aL(忽略导管中的气体体积)。
① 容器A中到达平衡所需时间ts,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)= 。
② 平衡后在A容器中再充入0.5 mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数(填“变大”、“变小”或“不变”) 。
③ 在②平衡后,打开K2,重新到达新平衡,B气囊的体积为0.8aL,则在打开K2之前,气囊B的体积为 L。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省锦州市高一下学期期末统考化学试卷(解析版) 题型:选择题
某温度下,在一固定容积的容器中进行反应:SO3(g)+NO(g) NO2 (g)+SO2(g),下列情况一定能说明已经达到化学反应限度的是
NO2 (g)+SO2(g),下列情况一定能说明已经达到化学反应限度的是
A.体系总压强不再随时间而改变 B.体系总质量不再随时间而改变
C.NO(g)和 NO2(g)的生成速率相同 D.SO3 (g)和 NO(g)的浓度比为 1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com