
����Ŀ����1�����ࡢ��֬�������ʺ�ά���ض�������Ļ���Ӫ�����ʣ��±�ΪijƷ������Ƭ��ǩ�е�һ���֡�

������Ƭ��Ӫ���ɷ��У�����ˮ��Ӧ���ɰ������Ӫ��������_________��ÿ��Ӫ����������ʱ�ų�����������_________��һ��Ӫ������������־���ᵽ�ġ�̼ˮ�������ָ_________������������Ԫ����_________��
��2��ά����C������ˮ������ˮ��Һ�е�����ɫʯ����Һ��ʯ����ɫ�����ȸ���Һ�����ڣ���ɫ��ʧ����ˣ��������ά����C��ʳ��ʱ��Ӧ��ע��_________���ڼ��������£�ά����C�ױ���������������ʱ��ü�һ��_________��
��3�����Ǵ����·�ͨ��������ά֯�ɵģ���������ά��������ë�����ڵȣ������շ��ɳ�������������ά����������ά��źֱ����ղ�������ζ���£�

����ë�ı��Ϊ_________�����ı��Ϊ_________�����ڵı��Ϊ_________��
���𰸡������� ��֬ ���� п ��Ҫ���¼��� ʳ�� �� �� ��
��������
��1���������ܷ���ˮ�����ɰ����ᡣ1����֬�����������ų�������Ϊ39.3ǧ����Զ��������͵����ʡ������ֳ���̼ˮ������ʴ�Ϊ�������ʣ���֬�����ࣻ
��2���ơ�þ���ƶ��dz���Ԫ�أ�п����Ԫ�ء�ά����C��ˮ��Һ�е�����ɫʯ����Һ��죬˵��ά����C��ˮ��Һ�����Եģ����������ڣ���ɫ��ʧ��˵��ά����C�������ױ������������������ά����C��ʳ��ʱ����Ҫ���¼��ȡ����������£�ά����C���ױ����������������������ʱ���һ���ʳ���к͡��ʴ�Ϊ��п����Ҫ���¼��ȣ�ʳ�ף�
��3����ë����ë���ǵ����ʣ����յ�ʱ����ζ����ͬ�ġ�����ֽ�ŵ���Ҫ�ɷֶ�����ά�أ�����ʱ��ζ��ͬ�������Ǻϳ���ά������ʱ����������ζ���ʴ�Ϊ���ۣ��ڣ��١�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ִ���ҵ�ķ�չ����CO2�Ĵ����ŷţ��Ի�����ɵ�Ӱ���������أ�ͨ�������Ƽ������ߵ�Ŭ�����Ѿ����������ཫCO2�������õļ��������д�ת�������Ӧ�ü�ֵ���ش��������⣺
��1���ڴ�ת������������CO2�Ĺ����У������漰���»�ѧ��Ӧ��
��CO2(g)+2H2O(1)![]() CH3OH(1)+
CH3OH(1)+![]() O2(g) ��H=+727kJ��mol-1 ��G=+703kJ��mol-1
O2(g) ��H=+727kJ��mol-1 ��G=+703kJ��mol-1
��CO2(g)+2H2O(1)![]() CH4(g)+2O2(g) ��H=+890kJ��mol-1 ��G=+818kJ��mol-1
CH4(g)+2O2(g) ��H=+890kJ��mol-1 ��G=+818kJ��mol-1
��CO2(g)+3H2(g)![]() CH3OH(1)+H2O(1) ��H=-131kJ��mol-1 ��G=-9.35kJ��mol-1
CH3OH(1)+H2O(1) ��H=-131kJ��mol-1 ��G=-9.35kJ��mol-1
��CO2(g)+4H2(g)![]() CH4(g)+2H2O(1) ��H=-253kJ��mol-1 ��G=-130kJ��mol-1
CH4(g)+2H2O(1) ��H=-253kJ��mol-1 ��G=-130kJ��mol-1
�ӻ�ѧƽ��ĽǶ�������������ѧ��Ӧ�з�Ӧ���г̶���С����____����Ӧ���г̶�������_____��
��2����ӦCO2(g)+4H2(g)=CH4(g) +2H2O(g)��ΪSabatier��Ӧ�����������˺��պ��칤ҵ���ҹ���ѧ�����߶Ը÷�Ӧ�Ĵ�������Ч�ʽ�����������о���
�������˺�����������Sabatier��Ӧʵ�ֻ���CO2����O2���䷴Ӧ������ͼ��ʾ�����ַ�������O2�����ȱ������Ҫ���ϲ���_________���ѧʽ����

����1.5 MPa����������Ϊ20 mL��min-lʱ�о��¶ȶԴ��������ܵ�Ӱ�죬�õ�CO2��ת����(%)���£�
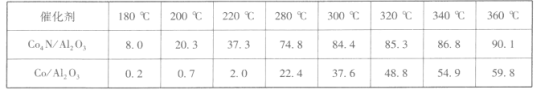
�����ϱ����ݿ�֪��_____���ѧʽ���Ĵ����ܸ��á�
�۵����������٣��о����ijһ������Ч�ʵ�Ӱ�죬�õ�CO2��ת����(%)���£�
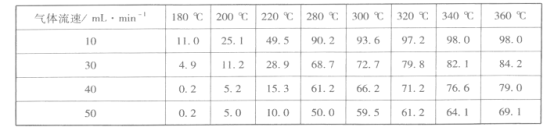
�����ϱ����ݿ�֪����ͬ�¶�ʱ�����������������ӣ�CO2��ת����____�������С����������ܵ�ԭ����_________________________________��
��������ʵ�������У�Sabatier��Ӧ����ܴﵽ��ѧƽ��״̬���¶���____����֪��ʼ��Ӧ������V(H2):V(CO2) =4:l��������¶��µ�ƽ�ⳣ��Ϊ ___________���г��������ʽ����
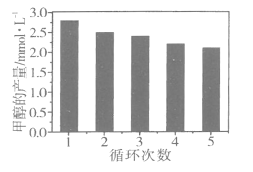
��3��ͨ���ı�������Ըı�CO2��H2��Ӧ��ת���IJ��������Co��C��Ϊ��������Ӧ����Եõ�������������ļ״���Ϊ���о��������ȶ��ԣ���Co/C����ѭ��ʹ�ã���ͬ�����£�����ѭ��ʹ�ô��������ӣ��״��IJ�����ͼ��ʾ�����Ʋ�״������仯��ԭ��_________________________________������֪Co��������Fe���ƣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�����Ļ�����壬���ܱ������з������·�Ӧ��xA��g����yB��g��![]() zC��g�����ﵽƽ�����A�����Ũ��Ϊ0.5 mol��L-1���������½��ܱ��������ݻ����������ٴﵽƽ����AŨ��Ϊ0.3 mol��L-1��������������ȷ����
zC��g�����ﵽƽ�����A�����Ũ��Ϊ0.5 mol��L-1���������½��ܱ��������ݻ����������ٴﵽƽ����AŨ��Ϊ0.3 mol��L-1��������������ȷ����
A. ƽ��������Ӧ�����ƶ� B. x+y��z
C. C ������������� D. B��ת�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��д��������������ˮ�ĵ��뷽��ʽ��
HNO3��________________________________________________________��
NH3H2O��_____________________________________________________��
��2����Ҫ��д������ʽ��
������ϡ���ᣨд�����ӷ���ʽ��_________________________________________��
������������Һ��ϡ���ᣨд�����ӷ���ʽ��_______________________________��
������ͭ��ϡ���ᣨд�����ӷ���ʽ��_____________________________________��
���Ʊ������������壨д����Ӧ�Ļ�ѧ����ʽ��_____________________________��
��CO32-+2H+=CO2��+H2O��д����Ӧ�Ļ�ѧ����ʽ��_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)���Ⱦ�Բ���ڶ�ά�ռ���������У����γ����ò�ͷ����ò㣬��ͼ1��ʾ�İ뾶��ȵ�Բ��������У�A����________�㣬��λ����________��B����________�㣬��λ����________��
(2)�������ò�һ��һ�������ά�ռ���ѻ����õ���ͼ2��ʾ��һ�ֽ�������ľ�����������Ϊ�������ѻ��������־����У�����ԭ�ӵ���λ����________��ƽ��ÿ��������ռ�е�ԭ����Ŀ��________��

(3)�����ϱ�����ֻ���ǵľ����е�ԭ�Ӿ�����ͼ2��ʾ�Ķѻ���ʽ����λ��Ԫ�����ڱ��ĵ�________���ڵ�__________�壬Ԫ�ط�����________��������Ӳ�ĵ����Ų�ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�������Ľṹʽ��ͼ������W��X��Y��ZΪԭ��������������Ķ�����Ԫ�أ�Yԭ�Ӻ�������������������Ӳ�����3����X��Zλ�ڲ�ͬ�����ڣ������й�˵����ȷ����

A.��̬�⻯������ȶ��ԣ�X>Y
B.X��W��Z�����γɵĻ����ﶼ��Һ��
C.W2Y2�мȺ����Լ��ֺ��Ǽ��Լ�
D.ZԪ���γɵĺ�����ȫ����ǿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������NaOH��Һ����CO2����Ũ����ȡ������Ϊ50mL��A��B����NaOH��Һ�У��ֱ�ͨ��һ������CO2����ϡ�͵�100mL����ϡ�ͺ����Һ����μ���0.1mol/L�����ᣬ����CO2���������״��������������������ϵ��ͼ��ʾ��
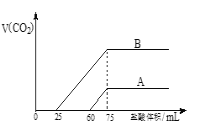
��1������B����ԭ��Һ��ͨ��CO2��������Һ�е�����Ϊ��д��ѧʽ��_____________�������ʵ���֮��Ϊ__________________����������0<v(HCl)<25 mLʱ���������ӷ�ӦΪ��____________��
��2������A���������ͨ���CO2�ڱ�״���µ����Ϊ_________mL��
��3��ͨ���������ԭNaOH��Һ�����ʵ���Ũ��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ����
A. 298 Kʱ��2H2S(g)��SO2(g)===3S(s)��2H2O(l)���Է����У�������H��0
B. ��ˮϡ�ͺ���Һ��c(NH4��)/c(NH3��H2O)��ֵ��С
C. ��⾫��ͭ�����У����������ļ�������������������һ�����
D. 25��ʱKa(HClO)��3.0��108��Ka(HCN)��4.9��1010�������¶���NaClO��Һ��NaCN��Һ��pH��ͬ����c(NaClO)��c(NaCN)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ֹ��ϵĸ���ֵ�����Դ��Ŀǰ��������������ڽ�����Ⱦ���ŷŵ�̼��Դ���ɳ�����Ч���ŷŵ�����Դ�����ܿ������������������ڣ�
һ����ȼ�ϵ��Ʊ�
(1)�ҹ���������Ҫ��Դ�ǽ�¯�����⣬���Ƶõ��������н϶��CO��H2S�����¸ɷ�������������������Ԫ��ת��Ϊ�������ɷ�����ķ�Ӧ����ʽΪ________��
(2)�ҹ�������Ա��ľмˮ����������ȡ��ȼ�ϣ���һ�������£���Ӧ���д������·�Ӧ��
i.CO2 (g) +C(s)=2CO (g) ��H1
ii.C(s) + H2O(g)=CO ( g) + H2 (g) ��H2
iii.C(s) + 2H2 (g)=CH4( g) ��H3
iv.CO(g) + H2O(g)=CO2 ( g) + H2 (g) ��H4
v. CH4(g)+ 2 H2O(g)= CO2 ( g) + 4H2 (g) ��H5
�١�H5=_________________ ��
���о��� CaO ������������CaO ��������Ca ����ľм����̼�����ʵ�����ȷ������750�棬����ˮ��������Ϊ 0.lg/(ming)�£�̽�������������Բ�����ֺ��������ܵ�Ӱ�죬��������ʾ��
n(Ca)/n(C) | ����������� | ̼ת����/% | |||
H2 | CO | CO2 | CH4 | ||
0 | 45.58 | 22.70 | 22.37 | 7.54 | 61.22 |
0.5 | 52.95 | 21.74 | 19.11 | 5.14 | 56.59 |
1.0 | 58.62 | 22.37 | 12.60 | 5.31 | 61.42 |
�ɱ������ݣ�n(Ca) / n(C) =___ʱ��Ϊ������ n(Ca) / n(C) ��0��0.5ʱ��H2����������������ӵ�ԭ��_____����ϵ�������¶Ȳ�����ľм���Ƚ�������Ӧ��Ӱ�� �����Ҷ� CaO ���� CO2 �������Լ� CaCO3�ķֽⷴӦҲ�кܴ�Ӱ�졣ʵ������У����� n(Ca) / n(C) Ϊ 1.0��ˮ��������Ϊ0.1 g/(min g)�� ��������Ӧ�¶ȴ�700������850�棬�����¶ȶԲ����ʡ������ʵ�Ӱ�������
�¶�/�� | ����������� | ̼ת����/% | ||
H2 | CO | CO2 | ||
700 | 51.78 | 20.75 | 19.89 | 54.37 |
750 | 58.62 | 22.37 | 12.60 | 61.42 |
800 | 55.63 | 26.05 | 12.71 | 73.43 |
850 | 54.16 | 26.94 | 13.82 | 83.34 |
�۴Ӳ����ʵĽǶȿ��ǣ���Ѳ����¶���________________��
�����ŷ�Ӧ�Ľ��У����� CaO �������������ͣ�ԭ����___________��
������ȼ�ϵĴ洢
(3)������������Һ��ȼ���У����Խ�������İ�ȫ��Ч�洢���������⡣���ڼ״����е�λ����������ߡ���¶ȵ͵��ŵ㣬�������Һ�崢��ƽ̨���ӡ��ҹ�ѧ�߹���һ��˫���ܽṹ�Ĵ�������Ӧ�����У��ڴ����ı���ͬʱ�ˮ�ͼ״�����ͼ�Ǽ״�����ת���ķ�Ӧ����( TS ��ʾ����̬����
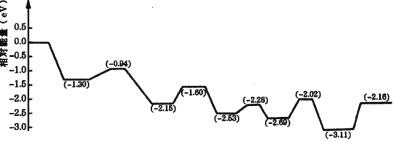
����ͼ���жϼ״����ⷴӦ�ж��ѵĻ�ѧ����______���÷�Ӧ�ġ�H___0( ������������������������С����)
������ȼ�ϵ�Ӧ�á�һ�����ܵ�ص�ԭ����ͼ��
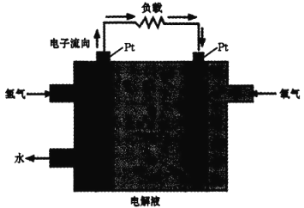
(4)�����ĵ缫��ӦʽΪ________���� Pt �缫���澵һ��ϸС��Ǧ�ۣ�ԭ����______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com