
| 1 |
| 2 |
| 1 |
| 2 |
| c(SO42-) |
| c(CO32-) |
| x |
| 2.0-x |
| 1.07×10-10 |
| 2.58×10-9 |
| 0.39mol |
| 0.079mol |


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:阅读理解
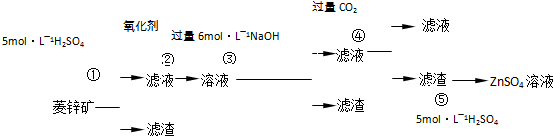
| 煅烧还原 |
| 水浸取 |
| 过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 |
 HS-+OH-
HS-+OH- HS-+OH-
HS-+OH-查看答案和解析>>
科目:高中化学 来源: 题型:
|
已知:BaSO4(s)+4C(s)=BaS(s)+4CO(g) △H=+571.2 kJ??mol-1
Ba(s)+S(s)+2O2(g):BaSO4(s) △H=—1473.2 kJ??mol-1
Ba(s)+S(s)=BaS(g) △H=—460 kJ??mol-1
请回答:
(1)工业上煅烧重晶石矿粉时,为使BaSO4得到充分还原和维持反应所需的高温,应采取的措施是 。
(2)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4(s)+CO2-3(aq)=BaCO3(s)+SO2-4(aq)
则:在实验室中将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为
(3)与高温煅烧还原法相比,用饱和Na2CO3溶液沉淀转化法的优点主要有
查看答案和解析>>
科目:高中化学 来源: 题型:
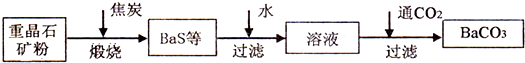
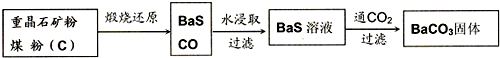
工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温煅烧还原法、沉淀转化法等。高温煅烧还原法的工艺流程可简单的表示如下:
![]()

已知:BaSO4(s)+4C(s)=BaS(s)+4CO(g)![]() 571.2 kJ?mol
571.2 kJ?mol![]()
Ba(s)+S(s)+2O2(g):BaSO4(s)![]() 1473.2 kJ?mol
1473.2 kJ?mol![]()
Ba(s)+S(s)=BaS(g)![]() 460 kJ?mol
460 kJ?mol![]()
请回答: .
(1)C(s)和O2(g)反应生成CO(g)的热化学方程式为 。
(2)工业上煅烧重晶石矿粉时,为使BaSO4得到充分的还原和维持反应所需的高温,应采取的措施是 。
(3)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4(s)+CO![]() (aq)= BaCO3(s)+SO
(aq)= BaCO3(s)+SO![]() (aq)
(aq)
则:① 在实验室将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为 。
② 与高温煅烧还原法相比,(用饱和Na2CO3溶液的)沉淀转化法的优点主要有 。
③ 已知:查看答案和解析>>
科目:高中化学 来源:安徽省合肥市2010届高三第一次教学质量检测 题型:填空题
|
已知:BaSO4(s)+4C(s)=BaS(s)+4CO(g) △H=+571.2 kJ•mol-1
Ba(s)+S(s)+2O2(g):BaSO4(s) △H=—1473.2 kJ•mol-1
Ba(s)+S(s)=BaS(g) △H=—460 kJ•mol-1
请回答:
(1)工业上煅烧重晶石矿粉时,为使BaSO4得到充分还原和维持反应所需的高温,应采取的措施是 。
(2)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4(s)+CO2-3(aq)=BaCO3(s)+SO2-4(aq)
则:在实验室中将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为
(3)与高温煅烧还原法相比,用饱和Na2CO3溶液沉淀转化法的优点主要有
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com