
【题目】硫酸锰在电解锰、染料、造纸以及陶瓷等工业生产中有广泛的应用。利用软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分ZnS)制得硫酸锰的流程如下:
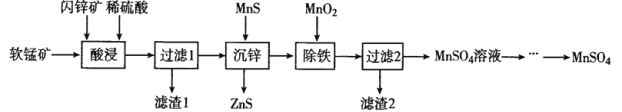
已知:常温下,Ksp(ZnS)=1.2×l0-24、Ksp(MnS)=1.5×10-15
关于该流程说法错误的是
A.“酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是作催化剂。
B.“沉锌”反应为:Zn2+(aq)+MnS(s)![]() ZnS(s)+Mn2+(aq),该反应的平衡常数K为1.25×109
ZnS(s)+Mn2+(aq),该反应的平衡常数K为1.25×109
C.“除铁”时加二氧化锰是为了氧化Fe2+,然后向溶液加适量氨水将溶液pH调节为3~4
D.该流程中可以循环利用的物质是ZnS
【答案】C
【解析】
A.酸浸时,为了缩短浸取时间,常加入少量FeSO4溶液,说明FeSO4能够加快化学反应速率,因此其作用可能是作催化剂,A正确;
B.“沉锌”反应为:Zn2+(aq)+MnS(s)![]() ZnS(s)+Mn2+(aq),该反应的平衡常数K=
ZnS(s)+Mn2+(aq),该反应的平衡常数K=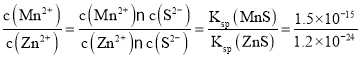 =1.25×109,B正确;
=1.25×109,B正确;
C.除铁时加二氧化锰是为了氧化Fe2+为Fe3+,反应的离子方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,在调整溶液pH时不能使用氨水,否则就会引入杂质离子NH4+,应该使用含有Zn2+或Mn2+的物质,如加入Zn(OH)2、ZnCO3、MnCO3等将溶液pH调节为3~4,C错误;
D.根据流程图可知:MnS沉锌得到ZnS,ZnS可循环到“酸溶”步骤中得到充分利用,故该流程中可以循环利用的物质是ZnS,D正确;
故合理选项是C。


科目:高中化学 来源: 题型:
【题目】黄酮类化合物具有抗肿瘤活性,6-羟基黄酮衍生物的合成路线如下:
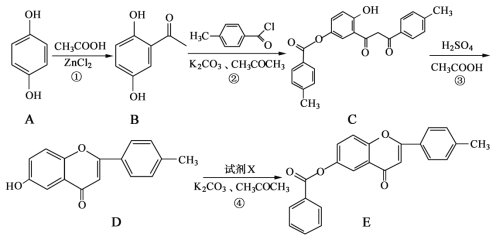
请回答下列问题:
(1)化合物B中的含氧官能团为__________和_____________(填名称)。
(2)反应③中涉及到的反应类型有水解反应、_____________和_____________。
(3)反应④中加入的试剂X的分子式为C7H5OCl,X的结构简式为________________。
(4)B的一种同分异构体满足下列条件,写出该同分异构体的结构简式:___________________
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有4种不同化学环境的氢。
(5)已知: 。根据已有知识并结合相关信息,写出以
。根据已有知识并结合相关信息,写出以![]() 和CH3COOH为原料制备
和CH3COOH为原料制备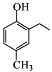 的合成路线流程图(无机试剂任选)__________。合成路线流程图示例:
的合成路线流程图(无机试剂任选)__________。合成路线流程图示例:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1LpH=10的NaOH溶液中持续通入CO2。通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示。下列叙述正确的是
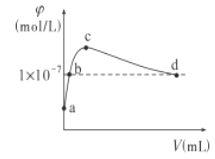
A.a点溶液中:水电离出的c(H+)=1×10-10mol/L
B.b点溶液中:n(Na+)=1×10-10mol
C.c点溶液中:c(Na+)>c(![]() )>c(
)>c(![]() )
)
D.d点溶液中:c(Na+)=2c(![]() )+c(
)+c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)T1K时,将1mol二甲醚引入一个抽空的150L恒容容器中,发生分解反应:CH3OCH3(g)CH4(g)+H2(g)+CO(g)。
反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
①由此计算:反应达平衡时,二甲醚的分解率为______,该温度下平衡常数Kc=______。(填数值)
②若升高温度,CH3OCH3的浓度增大,则该反应为______反应(填“放热”或“吸热”),在恒温恒容下,若要缩短上述反应达到平衡的时间,可采取的措施有______、______。
(2)在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)CH3CHO(g)。反应速率v=v正v逆=k正p(CO)p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5(kPa)-1,当CO转化率为20%时,![]() =______。
=______。
(3)工业上常用高浓度的K2CO3溶液吸收CO2得到溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示:
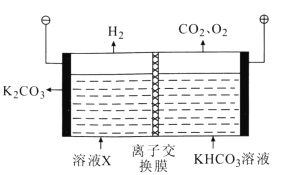
①在阳极区发生的反应包括(电极反应)______和H++![]() =CO2↑+H2O。
=CO2↑+H2O。
②用离子方程式表示![]() 在阴极区再生的过程:______。
在阴极区再生的过程:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,能一步实现下图所示①~⑤转化关系的是

X | Y | Z | W | |
A | C | CO | CO2 | Na2CO3 |
B | Fe3O4 | Fe | FeCl2 | FeCl3 |
C | H2SO4 | SO2 | S | SO3 |
D | Al | Al2O3 | NaAlO2 | Al(OH)3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是
A.氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解:Mg(OH)2+2![]() =Mg2++2NH3H2O
=Mg2++2NH3H2O
B.沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3++3H2O=Fe(OH)3↓+3H+
C.用食醋能清洗水垢:![]() +2CH3COOH=2CH3COO+H2O+CO2↑
+2CH3COOH=2CH3COO+H2O+CO2↑
D.84消毒液与洁厕灵混用产生有毒气体:ClO-+Cl-+2H+=Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,能使电离平衡H2O![]() H+ + OH-正向移动且溶液呈酸性的是( )
H+ + OH-正向移动且溶液呈酸性的是( )
A. 向水中加入NaHSO4溶液 B. 向水中加入Al2(SO4)3溶液
C. 向水中加入Na2CO3溶液 D. 将水加热到100℃,使水的pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的一种制取Cu2O的电解池示意图如下,电池总反应为2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
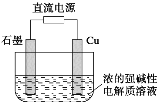
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1mol电子转移时,有0.1mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如下:
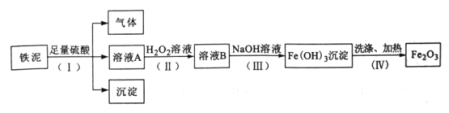
(1)步骤(I)中生成的气体是_____,溶液A和沉淀分离的操作名称是_______。
(2)步骤(Ⅱ)中加入H2O2溶液后,Fe2+被____(填“氧化”或“还原")成Fe3+。
(3)步骤(Ⅲ)中生成Fe(OH)3沉淀的颜色是_______(填“白色”或“红褐色")。
(4)步骤(IV)中Fe(OH)3受热分解生成Fe2O3和H2O的化学方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com