
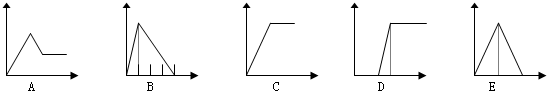
| 溶液 | 加入的物质 | 答案序号 |
| (1)饱和石灰水 | 通CO2至过量 | E |
| (2)AlCl3溶液 | 通过量的NH3 | C |
| (3)含少量HCl的AlCl3溶液 | 通过量的NH3 | D |
| (4)NaAlO2溶液 | 滴加稀HCl至过量 | B |
| (5)MgCl2 和AlCl3的混和液 | 滴加NaOH至过量 | A |
分析 (1)石灰水中通入二氧化碳,先生成沉淀,后沉淀消失,根据方程式判断前后两部分二氧化碳的物质的量关系;
(2)氯化铝中通过量的NH3生成氢氧化铝沉淀,沉淀不能溶解在过量氨水中;
(3)含少量HCl的AlCl3溶液通过量的NH3,先发生盐酸与氨气反应,不产生沉淀,然后发生氯化铝与NH3反应生成氢氧化铝沉淀,沉淀不能溶解在过量氨水中;
(4)NaAlO2溶液中加入稀盐酸,先生成氢氧化铝沉淀,后沉淀溶解,根据方程式判断前后两部分两部分消耗的盐酸体积;
(5)MgCl2和AlCl3混合溶液中滴加NaOH溶液生成两种沉淀,然后氢氧化铝与碱反应使沉淀的量减少,但不会完全溶解.
解答 解:(1)石灰水中通入二氧化碳,先发生Ca(OH)2+CO2═CaCO3↓+H2O,生成沉淀,后发生CO2+CaCO3+H2O═Ca(HCO3)2,沉淀消失,前后两部分二氧化碳的物质的量为1:1,故图象E符合;
(2)氯化铝中加入氨水生成氢氧化铝沉淀,沉淀不能溶解在过量氨水中,发生的反应为Al3++3OH-═Al(OH)3↓,故图象C符合;
(3)含少量HCl的AlCl3溶液通过量的NH3,先发生盐酸与氨气反应,不产生沉淀,然后发生氯化铝与NH3反应生成氢氧化铝沉淀,沉淀不能溶解在过量氨水中,故图象D符合;
(4)NaAlO2溶液中加入稀盐酸,发生反应NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,生成氢氧化铝沉淀,NaAlO2反应完毕后,发生反应,Al(OH)3+3HCl=AlCl3+3H2O,氢氧化铝溶解,前后两部分消耗的盐酸体积为1:3,故图象B符合;
(5)MgCl2和AlCl3混合溶液中滴加NaOH溶液发生Al3++3OH-═Al(OH)3↓、Mg2++2OH-═Mg(OH)2↓生成两种沉淀,然后发生Al(OH)3+NaOH═NaAlO2+2H2O,沉淀量减少但不会完全溶解,故图象A符合.
故答案为:E; C;D;B;A.
点评 本题以图象显示考查化学反应,难度中等,明确发生的化学反应是解答的关键,注意图象B、E中前后两部分的比例关系.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 浓盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20g重水(2H2O)含有10NA个电子 | |
| B. | 常温常压下,1摩氦气含有2NA个原子 | |
| C. | 100mL 1mol/L NaHCO3 溶液含有0.1NA个HCO3- | |
| D. | 5.6g金属铁与足量稀盐酸反应完全反应时,失去 0.3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 电解过程中共转移电子1.4mol | |
| B. | 原硫酸铜溶液的体积为1L | |
| C. | 在这个过程中共生成6.4gCu和0.5molO2 | |
| D. | 电解过程中阴极有0.3molH2生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com