
I����֪����Ӧ��H2(g) + Cl2(g) = 2HCl(g) ��H= ��184 kJ/mol
��4HCl(g)+O2(g)
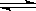 2Cl2(g)+2H2O(g)
��H= ��115.6 kJ/mol
2Cl2(g)+2H2O(g)
��H= ��115.6 kJ/mol


��ش�
��1��H2��O2��Ӧ������̬ˮ���Ȼ�ѧ����ʽ
��2���Ͽ�1 mol H��O ����������ԼΪ kJ��
II��ʵʩ�Լ�����Դ�˷Ѻͽ��ͷ����ŷ�Ϊ�������ݵĽ��ܼ������ߣ���Ӧ��ȫ���������⡢������Դ��Լ�͡������Ѻ������ı�Ȼѡ������ҵ�ķ�չ������Ϲ��ҽ��ܼ��ŵ�����Ҫ����������ѧ֪ʶ������������⣺
��1����֪ij��Ӧ��ƽ�����ʽΪ��  ��������Ӧ�Ļ�ѧ����ʽΪ��
��
��������Ӧ�Ļ�ѧ����ʽΪ��
��
��2����֪��400��ʱ��N2 (g)+ 3H2(g) 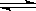 2NH3(g)
��H<0 ��K=0.5, ��400��ʱ����0.5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��ӦV(N2)�� V(N2)���������������������ȷ��������ʹ�ø÷�Ӧ�Ļ�ѧ��Ӧ���ʼӿ죬ͬʱʹƽ��ʱNH3������ٷ������ӣ��ɲ�ȡ����ȷ��ʩ�� ������ţ�
2NH3(g)
��H<0 ��K=0.5, ��400��ʱ����0.5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��ӦV(N2)�� V(N2)���������������������ȷ��������ʹ�ø÷�Ӧ�Ļ�ѧ��Ӧ���ʼӿ죬ͬʱʹƽ��ʱNH3������ٷ������ӣ��ɲ�ȡ����ȷ��ʩ�� ������ţ�
A����С�������ѹǿ B�������¶� C���Ӵ��� D��ʹ����Һ������
��3����һ��������ܱ������У��������»�ѧ��Ӧ��A(g) + 3B(g) 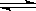 2C(g) + D��s�� ��H���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
2C(g) + D��s�� ��H���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
|
t/K |
300 |
400 |
500 |
�� |
|
K/(mol��L��1)2 |
4��106 |
8��107 |
K1 |
�� |
������������⣺
���жϸ÷�Ӧ�Ħ�H 0���>����<����
����һ�������£����жϸ÷�Ӧһ���ﻯѧƽ��״̬���� ������ţ���
A��3v(B)������=2v(C)������ B��A��B��ת�������
C��������ѹǿ���ֲ��� D�����������ܶȱ��ֲ���
�� ��1��2H2(g) + O2(g)= 2H2O(g) ��H= ��483.6 kJ/mol ��2��463.4
�� ��1��C��s��+H2O(g)  H2(g) + CO(g)
(2) = A (3) �� �� �� C
H2(g) + CO(g)
(2) = A (3) �� �� �� C
��������
�����������1���١�2+�ڵã�2H2(g) + O2(g)= 2H2O(g) ��H= ��483.6 kJ/mol��2��436KJ/mol+1mo498KJ/mol-4��XKJ/mol=��483.6 kJ/mol ���X=463.4KJ/mol��
II������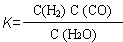 �ɵ÷�Ӧ����ʽ��H2O(g)+C(s)
�ɵ÷�Ӧ����ʽ��H2O(g)+C(s)  H2(g)+CO(g). ��2����֪��400��ʱ��N2(g)+ 3H2(g)
H2(g)+CO(g). ��2����֪��400��ʱ��N2(g)+ 3H2(g)  2NH3(g) ��H<0 ��K=0.5, ��400��ʱ����0.5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�������ʵ�Ũ����C(N2)=4mol/L;C(H2)=2mol/L;C(NH3)=4mol/L��ʱ���ʱC2(NH3)/{ C(N2)��C3(H2)}=42/(4��23)=1/8=0.5
= K,��ӦV(N2)����V(N2)��.�÷�Ӧ������Ӧ��һ�����������С�ķ��ȷ�Ӧ��A.����ѹǿ�����ڷ�Ӧ���������ʵ�Ũ�ȶ������������ʼӿ죬����ƽ�������������С�ķ����ƶ���Ҳ����������Ӧ�����ƶ�����ȷ��B�����¶ȣ���ѧ��Ӧ���ʼӿ죬���������¶Ȼ�ѧƽ�������ȷ�Ӧ�����淴Ӧ�����ƶ�������C�����������Ӧ���ʴ��ӿ죬����������ʹ��ѧƽ�ⷢ���ƶ�������D��ʹ����Һ�����ߣ�ƽ�������ƶ����������������Ũ�ȼ�С�����Է�Ӧ���ʼ���������������ʹ�ø÷�Ӧ�Ļ�ѧ��Ӧ���ʼӿ죬ͬʱʹƽ��ʱNH3������ٷ������ӣ�����Ӧ���ʼӿ����ƽ��������Ӧ�����ƶ����ɲ�ȡ����ȷ��ʩ��A.��С�������ѹǿ��(3)
�ٸ��ݳ���K���¶�t�Ĺ�ϵ��֪�����¶ȡ�K����˵�������¶Ȼ�ѧƽ��������Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����÷�Ӧ������Ӧ�����ȷ�Ӧ�����Ԧ�H ��0. ��A.�����ܷ�Ӧ�ﵽƽ��ʱ�κ����ʵ��������ʺͲ�������Ӧ����ȡ�����B ֻ�е�Ͷ���A��B�����ʵ����ıȷ��Ϸ���ʽ�еĸ����ʵ�ϵ����ϵ��ת������Ȳ���֤����Ӧ�ﵽƽ�⡣����C���÷�Ӧ��Ӧǰ������������ȣ���������ѹǿ���ֲ��䣬�������ʵ����ʵ������䣬��Ӧ�ﵽƽ�⡣��ȷ��D�����������ݻ����䣬�����Ƿ�Ӧ��Ҳ���ܷ�Ӧ���е�ʲô�̶ȣ����������ʵ��������䡣�����κ�ʱ�̣����۷�Ӧ�Ƿ�ﵽƽ�⣬���������ܶȶ����ᷢ���仯������
2NH3(g) ��H<0 ��K=0.5, ��400��ʱ����0.5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�������ʵ�Ũ����C(N2)=4mol/L;C(H2)=2mol/L;C(NH3)=4mol/L��ʱ���ʱC2(NH3)/{ C(N2)��C3(H2)}=42/(4��23)=1/8=0.5
= K,��ӦV(N2)����V(N2)��.�÷�Ӧ������Ӧ��һ�����������С�ķ��ȷ�Ӧ��A.����ѹǿ�����ڷ�Ӧ���������ʵ�Ũ�ȶ������������ʼӿ죬����ƽ�������������С�ķ����ƶ���Ҳ����������Ӧ�����ƶ�����ȷ��B�����¶ȣ���ѧ��Ӧ���ʼӿ죬���������¶Ȼ�ѧƽ�������ȷ�Ӧ�����淴Ӧ�����ƶ�������C�����������Ӧ���ʴ��ӿ죬����������ʹ��ѧƽ�ⷢ���ƶ�������D��ʹ����Һ�����ߣ�ƽ�������ƶ����������������Ũ�ȼ�С�����Է�Ӧ���ʼ���������������ʹ�ø÷�Ӧ�Ļ�ѧ��Ӧ���ʼӿ죬ͬʱʹƽ��ʱNH3������ٷ������ӣ�����Ӧ���ʼӿ����ƽ��������Ӧ�����ƶ����ɲ�ȡ����ȷ��ʩ��A.��С�������ѹǿ��(3)
�ٸ��ݳ���K���¶�t�Ĺ�ϵ��֪�����¶ȡ�K����˵�������¶Ȼ�ѧƽ��������Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����÷�Ӧ������Ӧ�����ȷ�Ӧ�����Ԧ�H ��0. ��A.�����ܷ�Ӧ�ﵽƽ��ʱ�κ����ʵ��������ʺͲ�������Ӧ����ȡ�����B ֻ�е�Ͷ���A��B�����ʵ����ıȷ��Ϸ���ʽ�еĸ����ʵ�ϵ����ϵ��ת������Ȳ���֤����Ӧ�ﵽƽ�⡣����C���÷�Ӧ��Ӧǰ������������ȣ���������ѹǿ���ֲ��䣬�������ʵ����ʵ������䣬��Ӧ�ﵽƽ�⡣��ȷ��D�����������ݻ����䣬�����Ƿ�Ӧ��Ҳ���ܷ�Ӧ���е�ʲô�̶ȣ����������ʵ��������䡣�����κ�ʱ�̣����۷�Ӧ�Ƿ�ﵽƽ�⣬���������ܶȶ����ᷢ���仯������
���㣺���黯ѧ���뷴Ӧ�ȵĹ�ϵ���Ȼ�ѧ����ʽ����д����������Ի�ѧƽ���Ӱ���ƽ��״̬���жϵ�֪ʶ��


 ÿ�α���ϵ�д�
ÿ�α���ϵ�д� ��ѧ����ϵ�д�
��ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� |
| �� |
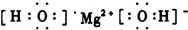
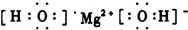
| �� |
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꽭��ʡ����12���¿����ۿ���ѧ�Ծ��������棩 ���ͣ������
I����֪����ӦH2(g) + Cl2(g) = 2HCl(g) ��H= ��184 kJ/mol
4HCl(g)+O2(g)  2Cl2(g)+2H2O(g)
��H= ��115.6 kJ/mol
2Cl2(g)+2H2O(g)
��H= ��115.6 kJ/mol


��ش�
��1��H2��O2��Ӧ������̬ˮ���Ȼ�ѧ����ʽ
��2���Ͽ�1 mol H��O ����������ԼΪ kJ
II����������ѧ֪ʶ������������⣺
��1����֪ij��Ӧ��ƽ�����ʽΪ�� ��������Ӧ�Ļ�ѧ����ʽΪ��
��������Ӧ�Ļ�ѧ����ʽΪ��
��2����֪��400��ʱ��N2 (g)+ 3H2(g)
 2NH3(g)
��H<0 ��K=0.5����400��ʱ����0.5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��Ӧv(N2)�� v(N2)���������������������ȷ������1�֣�
2NH3(g)
��H<0 ��K=0.5����400��ʱ����0.5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��Ӧv(N2)�� v(N2)���������������������ȷ������1�֣�
��ʹ�ø÷�Ӧ�Ļ�ѧ��Ӧ���ʼӿ죬ͬʱʹƽ��ʱNH3������ٷ������ӣ��ɲ�ȡ����ȷ��ʩ�� ������ţ���1�֣�
A����С�������ѹǿ B�������¶� C���Ӵ��� D��ʹ����Һ������
��3����һ��������ܱ������У��������»�ѧ��Ӧ��A(g) + 3B(g)  2C(g)
+ D��s�� ��H���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
2C(g)
+ D��s�� ��H���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
|
t/K |
300 |
400 |
500 |
�� |
|
K/(mol��L��1)2 |
4��106 |
8��107 |
K1 |
�� |
������������⣺
���жϸ÷�Ӧ�Ħ�H 0���>����<���� ��1�֣�
����һ�������£����жϸ÷�Ӧһ���ﻯѧƽ��״̬���� ������ţ�
A��3v(B)������=2v(C)������ B��A��B��ת�������
C��������ѹǿ���ֲ��� D�����������ܶȱ��ֲ���
��4������Ȼ��(�������ʲ����뷴Ӧ)Ϊԭ�ϵ�ȼ�ϵ��ʾ��ͼ��ͼ��ʾ��

�ٷŵ�ʱ�������ĵ缫��ӦʽΪ
�ڼ���װ����ʢװ100.0 mL 3.0 mol��L��1 KOH��Һ���ŵ�ʱ���뷴Ӧ�������ڱ�״�������Ϊ8 960 mL���ŵ���Ϻ������Һ�и�����Ũ�ȵĴ�С��ϵΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��ɽ��ʡ�����и�����ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
I����֪����Ӧ




��ش�
 ��Ӧ������̬ˮ���Ȼ�ѧ����ʽ__________________________
��Ӧ������̬ˮ���Ȼ�ѧ����ʽ__________________________
II��ʵʩ�Լ�����Դ�˷Ѻͽ��ͷ����ŷ�Ϊ�������ݵĽ��ܼ������ߣ���Ӧ��ȫ���������⡢������Դ��Լ�͡������Ѻ������ı�Ȼѡ����ҵ�ķ�չ������Ϲ��ҽ��ܼ��ŵ�����Ҫ����������ѧ֪ʶ������������⣺
��1����֪ij��Ӧ��ƽ�����ʽΪ��
������Ӧ�Ļ�ѧ����ʽΪ��_________________________________________________
��2����֪��400��ʱ����Ӧ

 =0��5����400��ʱ����0��5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��Ӧ
=0��5����400��ʱ����0��5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��Ӧ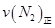 ____________
____________ �������������������ȷ������
�������������������ȷ������
��ʹ�ø÷�Ӧ�Ļ�ѧ��Ӧ���ʼӿ죬ͬʱʹƽ��ʱNH3������������ӣ�
�ɲ�ȡ����ȷ��ʩ��____________������ţ�
A���Ӵ��� B�������¶� C����С�������ѹǿ D��ʹ����Һ������
��3����һ��������ܱ������У��������»�ѧ��Ӧ��

 ���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���

������������⣺
���жϸ÷�Ӧ�� ___________0�������������
___________0�������������
����һ�������£����жϸ÷�Ӧһ���ﻯѧƽ��״̬����___________������ţ���
A�� B��������ѹǿ���ֲ���
B��������ѹǿ���ֲ���
C��A��B��ת������� D�����������ܶȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
I����֪����Ӧ H2(g) + Cl2(g) = 2HCl(g) ��H= ��184 kJ/mol
4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ��H= ��115.6 kJ/mol
2Cl2(g)+2H2O(g) ��H= ��115.6 kJ/mol
![]()

��ش�
��1��H2��O2��Ӧ������̬ˮ���Ȼ�ѧ����ʽ
��2���Ͽ�1 mol H��O ����������ԼΪ kJ��
II��ʵʩ�Լ�����Դ�˷Ѻͽ��ͷ����ŷ�Ϊ�������ݵĽ��ܼ������ߣ���Ӧ��ȫ���������⡢������Դ��Լ�͡������Ѻ������ı�Ȼѡ������ҵ�ķ�չ������Ϲ��ҽ��ܼ��ŵ�����Ҫ����������ѧ֪ʶ������������⣺
��1����֪ij��Ӧ��ƽ�����ʽΪ�� ![]() ��
��
������Ӧ�Ļ�ѧ����ʽΪ�� .
��2����֪��400��ʱ��N2 (g)+ 3H2(g) ![]() 2NH3(g) ��H<0 ��K=0.5, ��400��ʱ����0.5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��ӦV(N2)�� V(N2)���������������������ȷ������
2NH3(g) ��H<0 ��K=0.5, ��400��ʱ����0.5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��ӦV(N2)�� V(N2)���������������������ȷ������
��ʹ�ø÷�Ӧ�Ļ�ѧ��Ӧ���ʼӿ죬ͬʱʹƽ��ʱNH3������ٷ������ӣ��ɲ�ȡ����ȷ��ʩ�� ������ţ�
A����С�������ѹǿ B�������¶� C���Ӵ��� D��ʹ����Һ������
��3����һ��������ܱ������У��������»�ѧ��Ӧ��A(g) + 3B(g) ![]() 2C(g) + D��s�� ��H���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
2C(g) + D��s�� ��H���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| t/K | 300 | 400 | 500 | �� |
| K/(mol��L��1)2 | 4��106 | 8��107 | K1 | �� |
������������⣺
���жϸ÷�Ӧ�Ħ�H 0���>����<����
����һ�������£����жϸ÷�Ӧһ���ﻯѧƽ��״̬���� ������ţ���
A��3v(B)������=2v(C)������ B��A��B��ת�������
C��������ѹǿ���ֲ��� D�����������ܶȱ��ֲ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com