
将E和F加入固定容积的密闭容器中,在一定条件下发生反应:
E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
(1)60%(2分)
(2)>(1分);<(1分)
(3)>(1分);
该反应的正反应为吸热反应,升高温度平衡正向移动,平衡常数增大(1分)
(4)①④(2分,漏选得1分,错选不得分);
解析试题分析:(1)假设一开始加入的E的物质的量为amol
E(g) + F(s)  2G(g)
2G(g)
起始: amol 0mol
变化: bmol 2bmol
平衡:(a-b)mol 2bmol
依题意有:

915℃、2.0MPa时E的转化率为:60%
(2)该反应中由1mol的E生成2mol 的F,也就是说是一个熵增的方向,因此△S >0(1分);第二个空中使用控制变量法,先比较a和b的大小,对于这个反应来讲,温度一定条件下,压强越大,转化率越小,因此有: b <a<54℅,那么从表中可以看出,在二个大气压下,从上到下,随温度的升高,数值应该是越来越大,因此有b <a<54℅<75℅<f 。(3)从上到下温度越来越高,G的含量越来越大,意味着温度升高,平衡正向移动,表明正向是一个吸热的方向,因此平衡常数K(1000℃)> K(810℃);
(4)①混合气体的密度不再变化,那么反应物F的量不再变化,意味着各反应物和生成物的浓度都不再变化成了一定值,反应达到平衡,正确;②该反应的正反应为吸热反应,错误;③增大F的量,F是固体,浓度是定值,不会使得单位体积活化分子数增大,化学反应速率不变,错误;④恒温恒容条件下通入惰性气体,不改变各物质的浓度,平衡不移动,正确;⑤恒温恒压条件下通入惰性气体,各组分的浓度不变,化学反应速率不变,错误。
考点:考查化学平衡的有关知识。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:填空题
向一容积不变的密闭容器中充入一定量A和B,发生反应:xA(g)+2B(s) yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题: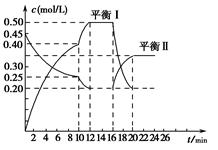
(1)用A的浓度变化表示该反应0~10 min内的平均反应速率v(A)=________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是________;第16 min引起曲线变化的反应条件可能是________。
①减压 ②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ的平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮气与氢气反应生成氨气的平衡常数见下表:
| | N2+3H2 2NH3 2NH3 | |||
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中的溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,当HA浓度为 时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
| 25℃平衡体系 | 平衡常数 | 焓变 | 起始总浓度 |
在水中,HA 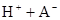 | 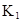 | 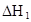 |  |
在苯中,2HA 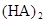 | 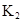 | 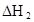 | 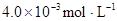 |
 (HA)2,反应在较低温度下自发进行,则
(HA)2,反应在较低温度下自发进行,则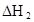 ___________0。
___________0。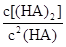 =130,则反应向___________方向进行。
=130,则反应向___________方向进行。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.(4分)在一体积为10L密闭的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
(1)CO和H2O浓度变化如图,则0~4 min的平均反应速率ν(CO)=_______ mol/(L·min),此时该反应的平衡常数为 。 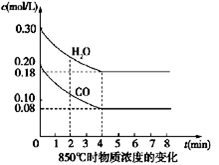
(2)当下列哪些物理量不再发生变化时,表明上述反应已达到平衡状态的是 。
| A.混合气体的压强 |
| B.混合气体的密度 |
| C.CO的物质的量浓度 |
| D.密闭容器中放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2 mol SO2和1 mol O2,乙中充入2 mol SO3和1 mol He,此时K停在0处。在一定条件下发生可逆反应:2SO2(g)+O2(g) 2SO3(g),反应达到平衡后,再恢复至原温度,回答下列问题:
2SO3(g),反应达到平衡后,再恢复至原温度,回答下列问题:
(1)若固定隔板K,能表示甲容器中一定达到化学平衡的是
| A.甲中气体的总压强不变 | B.各气体的物质的量浓度不变 |
| C.混合气体的平均摩尔质量不变 | D.混合气体的密度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料。工业合成氨的反应如下:N2(g) +3H2(g)  2NH3(g) △H=一92. 4 KJ·mol-1
2NH3(g) △H=一92. 4 KJ·mol-1
(1)2NH3(g)  N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
①单位时间内生成3n mol H2:同时生成2n mol NH3②用NH3、N2、H2表示反应速率比为2∶1∶3 ③混合气体的密度不再改变 ④混合气体压强不再改变 ⑤混合气体平均相对分子质量不再改变
| A.①③④ | B.①②④⑤ | C.①④⑤ | D.②③④ |
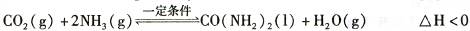
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2) /mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
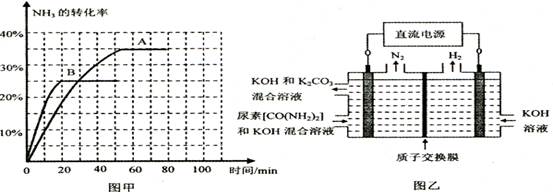
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为减少污染,常将煤转化为清洁气体燃料,可将焦炭与水蒸气反应转化为氢气和一氧化碳:C(s)+ H2O(g)  H2(g)+ CO(g)
H2(g)+ CO(g) 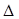 H>0。现在容积固定为2L密闭容器中,加入2mol C(s)和2mol H2O(g),在T℃下充分反应,半分钟后达到平衡,测得H2为0.75mol。
H>0。现在容积固定为2L密闭容器中,加入2mol C(s)和2mol H2O(g),在T℃下充分反应,半分钟后达到平衡,测得H2为0.75mol。
(1)用H2O(g)表示反应开始到达到平衡的平均速率 ;
(2)计算T℃下该反应的平衡常数K= ;若温度升高,则反应平衡常数将 (填“增大”“减小”或“不变”)。
(3)上述条件下该反应达到平衡状态,下列说法正确的是
| A.缩小容器体积,平衡向左移动 | B.加入催化剂,CO的产率增大 |
| C.增加碳的量,H2O(g)的转化率增大 | D.降低温度,H2O(g)的转化率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com