
����Ŀ����������п��������Ŀǰ������Ѭ��ɱ�����������ˮ���ᷴӦ�����ж�����좣�PH3����PH3���н�ǿ�Ļ�ԭ�ԣ����ڿ�������ȼ��������ȫ���涨����ʳ�������PH3�ƣ�������0.05mg/kg��ij��ѧ��ȤС���ͬѧͨ�����з�������ʳ�в������ﺬ�������о���
���������̡���װ����װ�á�PH3�IJ��������ա�ת��KMnO4������Һ�����������Һ�ζ�
��ʵ��װ�á�

C��ʢ��200gԭ����D��E��F ��ʢװ1.00mLŨ��Ϊ1.00��10��3mol/L��KMnO4 ��Һ��H2SO4 �ữ����
��ش������й����⣺
��1������G�������� ��������Ϊ����д��������ˮ��Ӧ�Ļ�ѧ����ʽ ��
��2�����Cװ�������Եķ����ǣ���ֹˮ�мн�Cװ�� ��ȡ���Ͽڻ�����©���м���ˮ�����¿��������۲쵽 ������װ�����������á�
��3��ʵ������У��ó����÷���������Ŀ���� ��
��4��A��ʢװKMnO4��Һ��Ϊ��ȥ�����п��ܺ��е� �����ԭ�����������������壻B��ʢװ����FeSO4��Һ�������� ��
��5����֪ D��E��F �з���ͬһ��Ӧ��ʵ���� PH3�����������ᣬд���������Ļ�ѧ��Ӧ����ʽ ���ռ�װ��D��E��F��������Һ����ϴ��D��E��F��������Һ��ϴ��Һһ��������ƿ�У���ˮϡ����25mL����Ũ��Ϊ5��10-4 mol/LNa2SO3����Һ�ζ�ʣ���KMnO4��Һ������Na2SO3����Һ11.00mL�����ԭ���������PH3�ƣ��ĺ���Ϊ mg/kg��
���𰸡�(1)��Һ©��;AlP+3H2O=Al��OH��3��+PH3��
(2)�������˵���Ƥ��;ˮ��ʼ�µ�һ��ʱ����������µ�
(3)��֤���ɵ�PH3ȫ��������KMnO4��Һ����
(4)��ԭ;��ȥ�����е�O2
(5)5PH3+8KMnO4+12H2SO4=5H3PO4+8MnSO4+4K2SO4+12H2O;0.085
��������
�����������1������G�������Ƿ�Һ©�������������Ϣ��������ˮ��Ӧ��ˮ������PH3��������������Ӧ�Ļ�ѧ����ʽΪ��AlP+3H2O=Al��OH��3��+PH3����
��2������װ���������������ѹǿ�仯����ֹˮ�мн�Cװ�ã���ֹˮ�мн�Cװ���������˵���Ƥ�ܣ�ȡ���Ͽڻ�����©���м���ˮ�����¿��������۲쵽ˮ��ʼ�µ�һ��ʱ����������µΣ�֤����������ã�
��3��ȷ�ⶨPH3�ĺ�������Ҫ�ø��������Һȫ�����գ���������ϴ������Գ������DZ�֤PH3ȫ�������յĴ�ʩ��
��4������װ��ͼ��װ���е��Լ�ѡ������жϣ����������Һ��ǿ�������������տ����еĻ�ԭ�����壻����ûʳ�����ȺͼӦ���ٺ�������Ӧ����������������������������PH3����������ȼ�գ��õζ������ⶨ��PH3��С�����ƫ�ͣ�
��5����ˮϡ����25mL����Ũ��Ϊ5��10-4mol/L Na2SO3����Һ�ζ�ʣ���KMnO4��Һ������Na2SO3����Һ11.00mL�����ݵζ���Ӧ��2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + K2SO4 + 5Na2SO4 + 3H2O��2KMnO4��5Na2SO3��δ��Ӧ�ĸ���������ʵ��� = 0.0110L��5��10-4mol/L��2/5 = 2.2��10-6mol����PH3��Ӧ�ĸ���������ʵ��� = 1.00��10-3mol/L��0.0030L-2.2��10-6mol = 8.0��10-7mol�����ݷ�Ӧ 5PH3 + 8KMnO4 + 12H2SO4 = 5H3PO4 + 8MnSO4 + 4K2SO4 + 12H2O���õ�������ϵΪ��5PH3��8KMnO4������õ�PH3���ʵ��� = 8.0��10-7mol��5/8 = 5.0��10-7mol����PH3���������� = 5.0*10-7 mol*34g/mol/0.2kg = 0.085g/kg��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶Ⱥ�ѹǿ�£�1���X2������3���Y2���廯������2������廯���������廯����Ļ�ѧʽΪ�� ��
A.X2Y3
B.XY3
C.XY
D.X3Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ƿ����һ�����ʵ���Ũ�ȵ���Һ��������ƿ�����ǣ� ��
A. ����� B. ��©ˮ��
C. �������Ƶ���Һ��ϴ���� D. �����������Ҫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ��������ֳƾ�������ѧʽΪ[Fe2��OH��n��SO4��3-0.5n]m���㷺������ˮ������ʵ�����������᳧��������Ҫ�ɷ�Ϊ���������P����FeS��SiO2�ȣ��Ʊ��������̷���FeSO4��7H2O�����������£�

��1����֤����W���պ���������庬��SO2�ķ����� ��
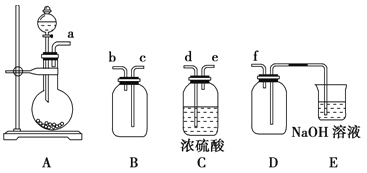
��2��ʵ�����Ʊ����ռ������SO2�������������¡�װ��A����SO2��д��ʵ�����Ʊ�SO2���廯ѧ����ʽ�� �������������Ӹ������ӿڣ�˳��Ϊa�� �� �� �� ��f��װ��D�������� ��
��3���Ʊ��̷�ʱ������ҺX�м������ ����ַ�Ӧ�� �����õ���ҺY���پ�Ũ�����ᾧ�Ȳ���õ��̷���
��4����ҺZ��pHӰ�����������������������pH��ֽ�ⶨ��ҺpH�����м�¼�����ȷ���ǣ��� ��
a. ��ˮ��PHΪ2.3 b. ����������Һ��PHΪ11.0
c. ��������Һ��PHΪ1 d. ����������Һ��PHΪ7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ���������Ϊa�������ʵ���Ũ��Ϊc1 mol��L-1��ϡ�������������һ������ˮ��ʹ���ʵ�����������Ϊ2a������ʱ��������ʵ���Ũ��Ϊc2 mol��L-1����c1��c2�Ĺ�ϵ�ǣ� ��
A��c2=2c1 B��c2>2c1 C��c2<2cl D��c1��2c2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������Һ��ֻ��Na+��CH3COO����H+��OH���������ӣ�������������ȷ����
A������Һ����pH=3��CH3COOH��pH=11��NaOH��Һ�������϶���
B������Һ���ɵ����ʵ���Ũ�ȡ��������NaOH��Һ��CH3COOH��Һ��϶���
C����������NaOH����Һ������Ũ��Ϊc(CH3COO������c(Na+ ����c(OH������c(H+��
D������������ˮ��c(CH3COO����һ������c(Na+����c(NH4+��֮��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ4NH3��g��+ 5O2��g��![]() 4NO��g��+ 6H2O��g��������������ȷ����( )
4NO��g��+ 6H2O��g��������������ȷ����( )
A���ﵽ��ѧƽ��ʱ��4������O2��= 5������NO ��
B������λʱ��������x mol NO��ͬʱ������x mol NH3 ����Ӧ�ﵽƽ��״̬
C���ﵽ��ѧƽ��ʱ�����������������������Ӧ���ʼ��٣��淴Ӧ��������
D����ѧ��Ӧ���ʹ�ϵ�ǣ�2������NH3��= 3������H2O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������н������·�Ӧ��X2(g)+Y2(g) ![]() 2Z(g)����֪X2��Y2��Z����ʼŨ�ȷֱ�Ϊ0.1mol/L��0.3mol/L��0.2mol/L����һ�������£�����Ӧ�ﵽƽ��ʱ�������ʵ�Ũ���п�����
2Z(g)����֪X2��Y2��Z����ʼŨ�ȷֱ�Ϊ0.1mol/L��0.3mol/L��0.2mol/L����һ�������£�����Ӧ�ﵽƽ��ʱ�������ʵ�Ũ���п�����
A��ZΪ0.3mol/L B��Y2Ϊ0.4mol/L C��X2Ϊ0.2mol/L D��ZΪ0.4mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����ʵ���;������ǣ�������Ϊ��;��
A. ��ˮ�Ҵ�������ɱ�������� B. ����裨��������оƬ��
C. ̼�����ƣ�����ʳƷ���ͼ��� D. �������������ɫͿ�ϣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com