
(14分)利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g) WI2(g) △H<0
WI2(g) △H<0
(1)该反应的平衡常数表达式K=_________。
(2)在恒温恒容条件下,能够说明上述反应一定达到平衡状态的是_________(填代号)。
a.I2(g)与WI2(g)的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.容器内混合气体的压强保持不变
(3)在一定温度下,若平衡常数K= ,向2L恒容密闭容器中加入l mol I2(g)和足量W(s),5 min后反应达到平衡。则0-5 min内的平均反应速率v(WI2)=_________,平衡时I2(g)的转化率为_________。相同温度下,若开始加入I2(g)的物质的量是原来的2倍,则下列数值是原来的2倍的是____(填代号)。
,向2L恒容密闭容器中加入l mol I2(g)和足量W(s),5 min后反应达到平衡。则0-5 min内的平均反应速率v(WI2)=_________,平衡时I2(g)的转化率为_________。相同温度下,若开始加入I2(g)的物质的量是原来的2倍,则下列数值是原来的2倍的是____(填代号)。
a.平衡常数 b.达到平衡的时间
c.I2的物质的量浓度 d.平衡时WI2的体积分数
(4)为提高该反应的反应速率,同时使 增大,可采取的措施为 ____________.
增大,可采取的措施为 ____________.
(5)工业上利用上述反应原理提纯金属钨的示意图如下:

反应在石英真空管中进行,先在温度为T2的一端放入未提纯的W粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的晶体,则温度T1_________T2(填“>”‘<”或“=”)。上述反应体系中循环使用的物质是_________.
(1)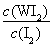 (2)bc (3)0.025mol?????L-1?min-1 25% c (4)升高温度 (5) > I2
(2)bc (3)0.025mol?????L-1?min-1 25% c (4)升高温度 (5) > I2
【解析】
试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此根据反应的方程式W(s)+I2(g) WI2(g)可知,该反应的平衡常数表达式K=
WI2(g)可知,该反应的平衡常数表达式K=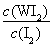
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此判断。a.平衡时浓度不变,但物质的浓度之间不一定相等或满足某种关系,所以I2与WI2的浓度相等不能说明反应达到平衡状态,a错误;b.W的质量不再变化,说明正逆反应速率相等,达到平衡状态,b正确;c.密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但气体的质量是变化的,因此密度是变化的,所以当容器内混合气体的密度保持不变时可以说明反应达到平衡状态,c正确;d.该反应是气体体积不变的可逆反应,压强始终不变,容器内混合气体的压强保持不变,不能说明反应达到平衡状态,d错误;选bc。
(3),根据方程式可知W(s)+I2(g) WI2(g)
WI2(g)
起始浓度(mol/L) 0.5 0
转化浓度(mol/L) x x
平衡浓度(mol/L) 0.5-x x K=x/(0.5-x)=1/3 解得x=0.125
v(WI2)=0.125/5=0.025mol?????L-1?min-1,平衡时I2(g)的转化率为(0.125÷0.5)×100%=25% ,
a.温度不变,平衡常数不变,错误;b.浓度增大,化学反应速率增大,达到平衡的时间缩短,错误;c.恒容密闭容器,增加I2的量,平衡不移动,I2的物质的量浓度是原来的2倍,正确;d.加入碘,平衡不移动,平衡时WI2的体积分数不变,错误;选c;
(4)提高该反应的化学反应速率,采取的措施为增大浓度,增大压强,升高温度和使用催化剂,但增大浓度,相当于增大压强,以及增大压强或者加入催化剂,平衡都不移动,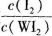 不变,升高温度,平衡逆向移动,比值增大,所以要提高该反应的反应速率,同时使
不变,升高温度,平衡逆向移动,比值增大,所以要提高该反应的反应速率,同时使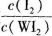 增大,可采取的措施只能是升高温度;
增大,可采取的措施只能是升高温度;
(5)根据题意可知,不纯W先转化成气体钨化物,即平衡正向移动,则采取降温的方法,通过气体扩散,再在右端,将气体钨化物转化成固体W,则采取升温的方法,所以温度T1大于T2,根据示意图可知,碘是可循环的物质。
考点:考查化学平衡表达式,平衡状态的判断,化学反应速率的计算,影响化学反应速率与平衡的因素。


科目:高中化学 来源:2014-2015山东省文登市高一上学期期末考试化学试卷(解析版) 题型:填空题
(14分)某小组同学欲探究NH3与O2反应的反应过程,按下列装置进行实验。

(1)A、B装置中可选药品:浓氨水、H2O2、CaO、CaCO3、MnO2、浓盐酸、蒸馏水。
①则A装置中发生反应的化学方程式为_____________________________;B装置中锥形瓶中盛放的药品是______。
②E装置中氨气被催化氧化生成一氧化氮时的化学方程式为_______________。
③F装置中可以看到有红棕色气体和白烟生成,红棕色气体是__________(填化学式,下同),白烟的成分____________。
(2)另一小组的同学撤掉A、C装置,只用剩余装置来完成此实验,B装置中分液漏斗盛放的是浓氨水,那么B装置中的锥形瓶中盛放的固体药品是_____________。
(3)工业上制取的浓硝酸往往呈黄色,该小组成员设计实验探究硝酸呈黄色的原因,提出如下假设,请你完成假设二。
假设一:可能含有Fe3+;假设二:可能含有_____;假设三:可能含有上述两种微粒。检验是否含有Fe3+的方法是:取少量样品于试管中,加水稀释,__________________________(补充操作步骤、现象和结论)。
(4)工业上用氨、氧气和水为原料制取硝酸铵,如果用17吨氨气,最多可制取_______吨硝酸铵 (硝酸铵的相对分子质量为80)。
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省文登市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列选项中的反应类型与其他三个选项反应类型不同的是
A.CH2 = CH2+H2O CH3CH2OH
CH3CH2OH
B. +HNO3
+HNO3
 +H2O
+H2O
C.CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
D.CH3COOH+Cl2 → ClCH2COOH+HCl
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省临沂市高一上学期期期末统考化学试卷(解析版) 题型:选择题
利用实验器材(规格和数量不限),能完成相应实验的一项是
实验器材(省略夹持装置) | 相应实验 | |
A | 烧杯、玻璃棒、蒸发皿 | 硫酸铜溶液的浓缩结晶 |
B | 三脚架、泥三角、玻璃棒、坩埚 | 煅烧石灰石制取生石灰 |
C | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
D | 酒精灯、烧杯、导管、集气瓶 | 用KClO3固体和MnO2固体制备并收集O2 |
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省临沂市高一上学期期期末统考化学试卷(解析版) 题型:选择题
下列物质的使用不涉及化学变化的是
A.明矾作净水剂 B.液氨用作制冷剂
C.氢氟酸刻蚀玻璃 D.生石灰作干燥剂
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省临沂市高二上学期期末化学试卷(解析版) 题型:选择题
液态肼(N2H4)-空气燃料电池的装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是

A.b极发生氧化反应
B.OH-问b极移动
C.放电时,电流从a极经过负载流向b极
D.a极的电极反应式:N2H4+4OH—-4e-=N2↑+4H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省临沂市高二上学期期末化学试卷(解析版) 题型:选择题
工业上合成氨的反应为N2(g)+3H2(g) 2NH3(g)△H<0,在其他条件不变的情况下,下列说法正确的是
2NH3(g)△H<0,在其他条件不变的情况下,下列说法正确的是
A.加入催化剂,逆反应速率不变
B.增大反应体系的压强,正反应速率一定增大
C.升高温度,反应速率加快,反应放出的热量减小
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源:2014-2015宁夏回族自治区银川一中高一上学期期末考试化学试卷(解析版) 题型:选择题
常温下,将液体Y滴加到盛有固体X的试管中,并在试管口对生成的气体进行检验。下表中固体X、液体Y及检测方法对应关系不恰当的是
选项 | 固体X | 液体Y | 检测方法 |
A | CaO | 浓氨水 | 蘸有浓盐酸的玻璃棒 |
B | Cu | 浓硝酸 | 湿润的蓝色石蕊试纸 |
C | MnO2 | 双氧水 | 带火星的木条 |
D | MnO2 | 浓盐酸 | 淀粉KI试纸 |
查看答案和解析>>
科目:高中化学 来源:2014-2015宁夏回族自治区银川一中高二上学期期末考试化学试卷(解析版) 题型:选择题
某元素原子的价电子构型是3s23p4,则它在周期表中的位置是
A.第四周期ⅡA族 B.第三周期ⅣA族
C.第三周期ⅥA族 D.第二周期ⅣA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com