
【题目】根据下列有关图象,说法正确的是( )
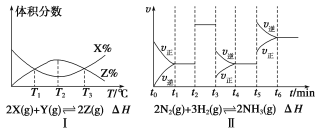

①由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的ΔH<0
②由图Ⅱ知,反应在t6时刻,NH3体积分数最大
③由图Ⅱ知,t3时采取减小反应体系压强的措施
④图Ⅲ表示在10 L容器、850 ℃时的反应,由图知,到4 min 时,反应放出51.6 kJ的热量
A.①③ B.②④ C.③④ D.②③
【答案】C
【解析】
试题分析:①由图Ⅰ知,反应在T1、T3处反应物和生成物的体积分数相对但反应不一定达到平衡,T2-T3升高温度,反应物体积分数增大,生成物体积分数减小,平衡向逆反应方向移动,所以正反应是放热反应,△H<0,故①错误;②由图Ⅱ知,t2时刻正逆反应速率都增大且相等,改变的条件是加入催化剂,平衡不移动;t3时刻正逆反应速率都减小,且逆反应速率大于正反应速率,改变的条件是减小压强,平衡向逆反应方向移动;t5时刻正逆反应速率都增大,且逆反应速率大于正反应速率,改变的条件是升高温度,平衡向逆反应方向移动,所以反应在t1时,NH3体积分数最大,故②错误;③由图Ⅱ知,t3时刻正逆反应速率都减小,且逆反应速率大于正反应速率,改变的条件是减小压强,故③正确;④该反应是一个放热反应,1molCO完全转化时放出43KJ能量,当转化(0.30-0.18)mol/L×10L=1.2molCO时放出51.6kJ的热量,故④正确;故选C。


科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F是元素周期表中前36号元素,它们的原子序数依次增大。A的质子数、电子层数、最外层电子数均相等,B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同,D的基态原子核外成对电子数是成单电子数的3倍,E4+与氩原子的核外电子排布相同,F是第四周期d区原子序数最大的元素。请回答下列问题:
(1)写出E的价层电子排布式_____________________。
(2)A、B、C、D电负性由大到小的顺序为__________(填元素符号)。
(3)F(BD)4为无色挥发性剧毒液体,熔点-25℃ ,沸点43℃。不溶于水,易溶于乙醇、乙醚、苯等有机溶剂,呈四面体构型,该晶体的类型为 ___ ,F与BD之间的作用力为 ______ 。
(4)开发新型储氢材料是氢能利用的重要研究方向。
①由A、B、E三种元素构成某种新型储氢材料的理论结构模型如下图1所示,图中虚线框内B原子的杂化轨道类型有 ______ 种。

②分子X可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X一定不是 _________ (填标号)。
A. H2O B. CH4 C. HF D. CO(NH2)2
③ F元素与镧( La)元素的合金可做储氢材料,该晶体的晶胞如上图2所示,在晶胞中心有一个F原子,其他F原子都在晶胞面上,则该晶体的化学式为____ ;已知其摩尔质量为M g.mol-1 ,晶胞参数为a pm ,用NA表示阿伏加德罗常数,则该晶胞的密度为___________ g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,由水电离的c(H+)=1×10-13mol/L的溶液中一定不可能大量存在的离子是
A. NH4+ B. HSO3- C. AlO2- D. Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A为甲、乙两种短周期元素组成的化合物,其摩尔质量为100g·mol – 1,甲元素的原子最外层电子数与K层电子数相等,E的水溶液显碱性,K为乙元素的单质。C为单质,其原子在周期表中半径最小。D为气体,对空气的相对密度为1.103。在适当的条件下,它们相互之间有如下图所示的转化关系:

试填写下列空白:
(1)甲元素的单质在空气中燃烧产物除了得到A外,还可得到_____________,物质F的电子式为____________。
(2)反应“E+D→G+B”是制硝酸工业中的重要反应之一,其方程式为______________“E+CuO”的化学方程式为_________________
(3)C和D还能在一定条件下反应生成另一种化合物I,I与一种弱酸的酸性氧化物反应生成强酸,该反应的离子方程式为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,已知:铝热反应放热,①4Al(s)+3O2(g)=2Al2O3(s) H1②4Fe(s)+3O2(g)===2Fe2O3(s) H2 下面关于 H1、H2 的比较正确的是( )
A. H1<H2 B. H1=H2 C. H1>H2 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:

(1)电源B极的名称是________。
(2)如果收集乙装置中两极产生的气体,两极气体的物质的量之比是________。
(3)甲装置中电解反应的总化学方程式:_______________________。
(4)欲用丙装置给铁镀锌,G应该是_______(填“铁”或“锌”),电镀液的主要成分是_______(填化学式)。
(5)装置丁中的现象是___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法,化合物![]() 的名称是2,3,5,5-四甲基-4,4-二乙基己烷
的名称是2,3,5,5-四甲基-4,4-二乙基己烷
B.等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等
C.苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色
D.结构片段为 的高聚物,其单体是甲醛和苯酚
的高聚物,其单体是甲醛和苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 工业上可通过CO和H2化合制得CH3OH: CO(g)+2H2(g) ![]() CH3OH(g) ΔH (CO结构式为C≡O)。又知某些化学键的键能(断开 1 mol化学键时所需要的最低能量)数值如下表:
CH3OH(g) ΔH (CO结构式为C≡O)。又知某些化学键的键能(断开 1 mol化学键时所需要的最低能量)数值如下表:
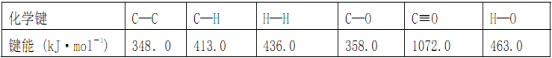
则ΔH =_____________,在相应的反应条件下,将 1 mol CO(g)与足量H2混合充分反应后,则放出或吸收的热量Q ________ ΔH 的数值(填“>”、“=”或“<”)。
Ⅱ.电化学降解NO3-的原理如右图所示。

①电源 A 极为________(填“正极”或“负极”),阴极反应式为_______________。
②若电解过程中转移了 1 mol 电子,则膜左侧电解液的质量减少量为________g。
Ⅲ.已知NO2和N2O4的相互转化反应:2NO2(g)![]() N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为 2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图:
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为 2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图:

①图中共有两条曲线X和Y,其中曲线________表示NO2浓度随时间的变化。下列不能说明该反应已达到平衡状态的是________。
A. 容器内混合气体的压强不随时间变化而改变
B. 容器内混合气体的密度不随时间变化而改变
C. 容器内混合气体的颜色不随时间变化而改变
D. 容器内混合气体的平均分子量不随时间变化而改变
②前 10 min内用NO2表示的化学反应速率v(NO2)=________mol/(L·min)。
③反应 25 min 时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是_____________(用文字表达);其平衡常数 K(d)________K(b)(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法不利于“开源节流”的是
A. 开发太阳能、水能、风能、地热能等新能源
B. 大力开采煤、石油和天然气,以满足人们日益增长的能源需求
C. 大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
D. 减少资源消耗,注重资源的重复使用、资源的循环再生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com