
��1��������100mL 0.1mol��L-1 H2C2O4�����ᣬҲ���Ҷ��ᣩ��ҺpH=2��
�ٽ���ϡ��10������ҺpH 3���<������>����=��������ʱͬ���0.01 mol��L-1ϡ��������ֱ������п��Ӧ��ϡ����ų���������� ����ࡱ�����١�����ȡ�����
�������м����������ƹ��壬��������������� ��
A.c(H2C2O4) B.c(OH-) C.ˮ�����ӻ� D.��Һ������
��2����������������Һ����0.01mol/L��CH3COOH��Һ����pH=2��ϡ���ᡢ
��pH=12��ʯ��ˮ����0.01mol/L��KOH��Һ��
����ˮ�ĵ���̶������� �����ţ�������pH=2�Ĵ�����Һ�����Һ�������ϣ�������ҺpH 7���<������>����=������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��ϩ����H2�ӳɺ�IJ�����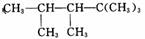 �����ϩ���Ľṹʽ������
�����ϩ���Ľṹʽ������
A. 1�� B. 2�� C. 3�� D. 4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����и���Һ�У�����һ���ܴ���������ǣ� ��
A��ǿ������Һ�У�K����Al3����CH3COO����SO42��
B��ˮ���������c(H+)=10��13mol/L����Һ��K+��HCO ��Br����Ba2+
��Br����Ba2+
C�������£�pH��1����ɫ��Һ�У�NH4����Mg2+��SO42����Cl-
D�������£�pH��1����Һ�У�Na����Fe2����NO3����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵�����ʾ������ȷ����
A. ������ȼ����Ϊ-316.3kJ��mol-1������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ��H= -316.3kJ��mol-1
B. 500�桢30MPa�£���0.5mol N2(g)��1.5molH2(g)�����ܱյ������г�ַ�Ӧ
NH3(g)������19.3kJ�����Ȼ�ѧ����ʽΪ��
N2 (g) + 3H2(g)  2NH3(g) ��H=-38.6kJ��mol-1
2NH3(g) ��H=-38.6kJ��mol-1
C. ��C��ʯī��= C�����ʯ����H=+1.90kJ��mol-1 ����֪���ʯ��ʯī�ȶ�
D. ��H+(aq)+OH-(aq)=H2O(l) ��H=-57.3kJ��mol-1����֪����0.5molH2SO4��Ũ��Һ
�뺬1molNaOH��ϡ��Һ��ϣ��ų�����������57.3 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��1��105 Pa��298 K������2H2(g)��O2(g)===2H2O(g)����H����484 kJ��mol��1
����1g H2O (l)��Ҫ���յ�����Ϊ2.5 kJ�������������±���
| H2(g) | O2(g) | H2O(l) | |
| 1 mol�����еĻ�ѧ�� ����ʱ��Ҫ���յ�����/kJ | 436 | 746 | a |
�����aΪ
A��350 �� B��548 C��1096 D��2192
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������������ɫ�仯�Ļ�ѧ����ʽ�������ӷ���ʽ����ʾ��ȷ���� �� ��
A����¶�ڿ����У�����ɫNa2 O2��ɰ�ɫ���壺Na2O2 +H2O 2Na+ +2OH��+O2 ��
B��������-15��ʱ������ɫNO2�����ɫҺ�壺2NO2  N2O4
N2O4
C����AgCl����Һ�м������Ʊ�ڣ�2Ag+ +S2�� Ag2S��
D����CuSO4��Һ�м���Ba��OH��2��Һ���۲쵽��ɫ��������:Cu2+ +2OH�� Cu(OH)2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ�������£���һ���Ϊ2L�ĺ����ܱ������г���2mol A��1mol B���������·�Ӧ��
2A��g��+B  3C��g������H=��QkJ/mol��Q>0��������60s�ﵽƽ�⣬���B���ʵ���
3C��g������H=��QkJ/mol��Q>0��������60s�ﵽƽ�⣬���B���ʵ���
Ϊ0.2mol�����жԸ�ƽ���������ȷ���� �� ��
A����C��Ũ�ȱ仯��ʾ�÷�Ӧ����Ϊ2��4mol��L-1��min-1
B����ʹ������Ϊ1L����C�����ʵ���һ������
C���ﵽƽ�⣬��÷ų�����ΪxkJ����x=Q
D�����������ٳ���1mol C�����´ﵽƽ�⣬A������������ֲ��䣬��BΪ��̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£���pH=3�������10-3 mol��L��1�İ�ˮ�������ͺ�,��Һ������Ũ�ȹ�ϵ��ȷ����( )
A��[NH4+]>[Cl-]>[H+]>[OH-] B��[NH4+]>[Cl-]>[OH-]>[H+]
C��[Cl-]>[NH4+]>[H+]>[OH-] D��[Cl-]>[NH4+]>[OH-]> [H+]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ���������ճ�������������Ҫ��Ӧ�á�����������ȷ����
A������β���к��е�������������Ͳ���ȫȼ����ɵ�
B�����������������ڽ��ػ����������������ָ��£������������ǽ�������
C�����л��������ܻ������������ö��������������ù��˵ķ�����ȥ
D���ߴ��ȵĶ������������������ά�����ά��ǿ����Һ�ᡰ��·��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com