
已知E(C-H)=414.4 kJ·mol-1;E(C![]() C)=615.3 kJ·mol-1;E(C-C)=347.4 kJ·mol-1;E(H-H)=435.3 kJ·mol-1
C)=615.3 kJ·mol-1;E(C-C)=347.4 kJ·mol-1;E(H-H)=435.3 kJ·mol-1
且已知乙烷(C2H6)可以裂解为乙烯和氢气,请根据化学反应中化学键的改变和键能的变化来推断该反应是放热反应还是吸热反应,并计算反应热的数值.乙烷和乙烯的结构如下:
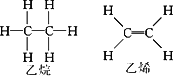
|
答案:反应是吸热的,每反应掉1 mol乙烷,吸收的热量为125.6 kJ 解析:从键能数据估算反应热的具体方法和步骤如下: (1)写出反应的化学方程式,并突出反应物和生成物分子中的各个化学键.
(2)归纳出化学键改变的情况.6C-H+C (3)查出有关键能的数据. (4)根据下列公式粗略地估计反应热(ΔH). ΔH=∑E(反应物)-∑E(生成物) ΔH=[2E(C-H)+E(C-C)]-[E(C =(2×414.4+347.4)kJ·mol-1-(615.3+435.3)kJ·mol-1 =125.6 kJ·mol-1 这表明,上述反应是吸热的,吸收的热量为125.6 kJ·mol-1. |


科目:高中化学 来源:三点一测丛书 高中化学(选修)化学反应原理 江苏版课标本 江苏版课标本 题型:038
已知E(C-H)=414.4 kJ/mol;E(C![]() C)=615.3 kJ/mol;E(C-C)=347.4 kJ/mol;E(H-H)=435.3 kJ/mol,且已知乙烷(C2H6)可以裂解为乙烯和氢气,请根据化学反应中化学键的改变和键能的变化来推断该反应是放热反应还是吸热反应,并计算反应热的数值.
C)=615.3 kJ/mol;E(C-C)=347.4 kJ/mol;E(H-H)=435.3 kJ/mol,且已知乙烷(C2H6)可以裂解为乙烯和氢气,请根据化学反应中化学键的改变和键能的变化来推断该反应是放热反应还是吸热反应,并计算反应热的数值.
查看答案和解析>>
科目:高中化学 来源:三点一测丛书 高中化学 必修2 (江苏版课标本) 江苏版课标本 题型:038
已知E(C-H)=414.4 Kj/mol;E(C![]() C)=615.3 kJ/mol;E(C-C)=347.4kJ/mol;E(H-H)=435.3kJ/mol.
C)=615.3 kJ/mol;E(C-C)=347.4kJ/mol;E(H-H)=435.3kJ/mol.
且已知乙烷(C2H6)可以裂解为乙烯和氢气,请根据化学反应中化学键的改变和键能的变化来推断该反应是放热反应还是吸热反应,并计算反应热的数值.乙烷和乙烯的结构如下:
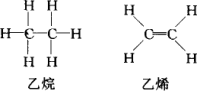
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省高三上学期第三阶段考试化学试卷(解析版) 题型:实验题
某研究性学习小组利用H2还原法测定两种铜的氧化物CuO、Cu2O混合粉末中铜元素的质量分数。下图是测定装置的示意图,A中的试剂是盐酸。
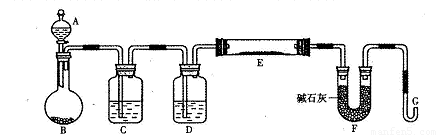
请回答下列问题。
(1)烧瓶中装入的试剂是锌粒,其中将发生反应的离子方程式是 ;
(2)试剂C是水,其作用是__ __;
(3)试剂D是__ __,其作用是干燥氢气;
(4)连接好装置后的实验操作依次是_ __(填下列操作序号)
①检验氢气纯度;②加热E;③检验装置气密性;④点燃G管溢出的气体;⑤从A瓶逐滴滴加液体
(5)已知:C(s)+1/2O2( g)= CO(g) △H=-110.5kJ·mol-1,
Cu2O(s) +1/2O2(g) = 2CuO(s) △H=-145 kJ·mol-1
则用炭粉在高温条件下还原CuO生成Cu2O的热化学方程式:____ 。
查看答案和解析>>
科目:高中化学 来源:2014届天津市高二第一次月考化学试卷(解析版) 题型:填空题
(10分)已知:a、H+(aq) + OH-(aq) = H2O(l) △H=-57.3 kJ•mol-1;
b、1.6gCH4完全燃烧生成水蒸气时放热80.2kJ,1g水蒸气转化成液态水放热2.444kJ。
(1)氢氧化钠与硫酸两稀溶液发生反应,写出表征其中和热的热化学方程式:
(2)写出表征甲烷燃烧热的热化学方程式:
(3)已知2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
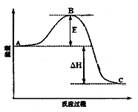
① 图中C表示 E的大小对该反应的反应热有无影响? 。
② 该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
① Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= ―24.8 kJ•mol-1
② 3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H= ―47.2 kJ•mol-1
③ Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5 kJ•mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com