
| A. | HA为强酸 | B. | 该混合液pH=7 | ||
| C. | 该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) | D. | 该混合溶液中:c(A-)+c(OH-)=c(Na+)+c(H+) |
分析 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,二者恰好完全反应生成0.1mol/L的NaA,根据HA的强弱判断NaA溶液酸碱性,结合电荷守恒和物料守恒判断.
解答 解:A.常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,二者恰好完全反应生成0.1mol/L的NaA,说明HA是一元酸,但不能说明HA电离程度,所以无法判断HA强弱,故A错误;
B.如果HA是强酸,NaA是强酸强碱盐,其水溶液呈中性,如果HA是弱酸,NaA是强碱弱酸盐,其水溶液呈碱性,故B错误;
C.如果HA是强酸,则NaA是强酸强碱盐,溶液呈中性,溶液中离子浓度大小顺序是:c(Na+)=c(A-)>c(OH-)=c(H+);如果HA是弱酸,则NaA是强碱弱酸盐,其水溶液呈碱性,则c(OH-)>c(H+),结合电荷守恒得:c(Na+)>c(A-),盐类水解较微弱,所以离子浓度大小顺序是:c(Na+)>c(A-)>c(OH-)>c(H+),故C错误;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(A-)+c(OH-)=c(Na+)+c(H+),故D正确;
故选D.
点评 本题以酸碱混合溶液定性判断为载体考查离子浓度大小比较,为高频考点,正确判断溶液中溶质及其性质是解本题关键,易错选项是AD,电荷守恒与溶液酸碱性及浓度无关,题目难度不大.


科目:高中化学 来源: 题型:解答题
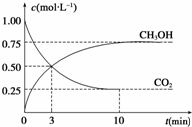 新华社2009年10月15日报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更好更快地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:
新华社2009年10月15日报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更好更快地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ②④ | C. | ①③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用焰色反应可鉴别NaCl和KCl | |
| B. | 氢氟酸可用于刻蚀玻璃,是利用SiO2酸性氧化物的性质 | |
| C. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 | |
| D. | 在食品包装袋中放入硅胶防止食品变质,是利用硅胶的吸水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
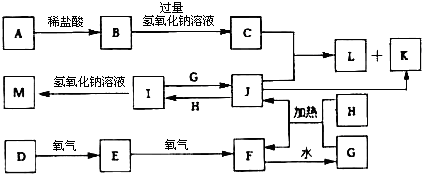
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24L | |
| B. | 0.1mol/L的NaHSO4溶液中含有阳离子的物质的量为0.2mol | |
| C. | 7.8gNa2S和7.8gNa2O2中含有的阴离子 数目均为0.1NA | |
| D. | 1.8g18O2分子与1.8g18O3分子中含有的中子数不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合体系中气体密度发生变化 | B. | 正、逆反应速率改变 | ||
| C. | 混合物中各组分的浓度改变 | D. | 反应物的转化率改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
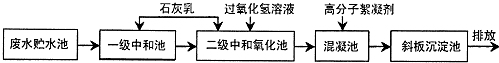
| 离子 | H+ | Cl- | Fe2+ | Fe3+ |
| 浓度(mol•L)-1 | 0.16 | 0.94 | 0.18 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com