
纳米材料二氧化钛(TiO2)可做优良的催化剂。
| 资料卡片 | | |
| 物质 | 熔点/℃ | 沸点/℃ |
| SiCl4 | -70 | 57.6 |
| TiCl4 | -25 | 136.5 |

 _________。
_________。 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
| 资料卡片 | ||
| 物质 | 熔点/℃ | 沸点/℃ |
| SiCl4 | -70 | 57.6 |
| TiCl4 | -25 | 136.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)(1)纳米材料二氧化钛(TiO2)可做优良的催化剂.
据报道:“生态马路”是在铺设时加入一定量的TiO2, TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
①b中破坏的是__________ (填“极性共价键”或“非极性共价键”).
②H2O2能清除路面空气中的等,其主要是利用了 H2O2的作用是_____________________________________________(填“氧化性”或“还原性”).
(2)某固体混合物中含有Na+、K+、Mg2+和Cl-、Br-五种微粒.
I.欲将钠、钾、镁三元素大致分离开来,并将氯、溴两元素大致分离开来,有以下方法和操作步骤可供选择(其中有的步骤可选两次).
①溶于水制成稀溶液;②溶于水制成浓溶液;③通入足量CO2;④加入足量氯水;
⑤通入足量氨气; ⑥过滤; ⑦用四氯化碳萃取.
选取最合理的方法和步骤:(按顺序先后填写编号) .
II.分离后剩余的水溶液中所含的主要物质是 .
III.在上述分离过程中分离出一种化合物晶体.欲得到干燥的该化合物固体,有两种方法可供选择:①.加热蒸发掉水分;②.将过滤得到的固体物质自然风干.正确的方法应选择______________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米材料二氧化钛(TiO2)可做优良的催化剂。
| 资料卡片 |
|
|
| 物质 | 熔点/℃ | 沸点/℃ |
| SiCl4 | -70 | 57.6 |
| TiCl4 | -25 | 136.5 |
Ⅰ. 工业上二氧化钛的制备方法:
① 将干燥后的金红石(主要成分为TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
② 将SiCl4分离,得到纯净的TiCl4。
③ 在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
④ TiO2·xH2O高温分解得到TiO2。
(1) 根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是____________,分离二者所采取的操作名称是________________。
(2) ③中反应的化学方程式是________________________________________________。
(3) 若④在实验室完成,应将TiO2·xH2O放在________________(填仪器名称)中加热。
Ⅱ. 据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a. O2―→2O b. O+H2O―→2OH c. OH+OH―→H2O2
(4) b中破坏的是______________(填“极性共价键”或“非极性共价键”)。
(5) H2O2能清除路面空气中的CxHy、CO等,主要是利用了H2O2的____________(填“氧化性”或“还原性”)。
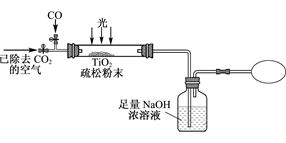
Ⅲ. 某研究性学习小组用下列装置模拟“生态马路”清除CO的原理。(夹持装置已略去)
(6) 若缓慢通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重16.5g,则CO的转化率为____________。
(7) 当CO气体全部通入后,还要通一会儿空气,其目的是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三12月阶段性测试化学试卷(解析版) 题型:实验题
纳米材料二氧化钛(TiO2)可做优良的催化剂。
|
资料卡片 |
|
|
|
物质 |
熔点/℃ |
沸点/℃ |
|
SiCl4 |
-70 |
57.6 |
|
TiCl4 |
-25 |
136.5 |

Ⅰ. 工业上二氧化钛的制备方法:
① 将干燥后的金红石(主要成分为TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
② 将SiCl4分离,得到纯净的TiCl4。
③ 在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
④ TiO2·xH2O高温分解得到TiO2。
(1) 根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是_____,分离二者所采取的操作名称是__。
(2) ③中反应的化学方程式是____________________________________________。
(3) 若④在实验室完成,应将TiO2·xH2O放在________________(填仪器名称)中加热。
Ⅱ. 据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2。
(4) H2O2能清除路面空气中的CxHy、CO等,主要是利用了H2O2的____________(填“氧化性”或“还原性”)。
(5). 某研究性学习小组用图装置模拟“生态马路”清除CO的原理。(夹持装置已略去)若缓慢通入224L(已折算成标准状况)CO气体,结果NaOH溶液增重16.5g,则CO的转化率为___ _________。

(6) 当CO气体全部通入后,还要通一会儿空气,其目的是 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省南京市高三第四次模拟考试(理综)化学部分 题型:实验题
纳米材料二氧化钛(TiO2)可做优良的催化剂。
|
资料卡片 |
|
|
|
物质 |
熔点/℃ |
沸点/℃ |
|
SiCl4 |
-70 |
57.6 |
|
TiCl4 |
-25 |
136.5 |
Ⅰ. 工业上二氧化钛的制备方法:
① 将干燥后的金红石(主要成分为TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
② 将SiCl4分离,得到纯净的TiCl4。
③ 在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
④ TiO2·xH2O高温分解得到TiO2。
(1) 根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是____________,分离二者所采取的操作名称是________________。
(2) ③中反应的化学方程式是________________________________________________。
(3) 若④在实验室完成,应将TiO2·xH2O放在________________(填仪器名称)中加热。
Ⅱ. 据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a. O2―→2O b. O+H2O―→2OH c. OH+OH―→H2O2
(4) b中破坏的是______________(填“极性共价键”或“非极性共价键”)。
(5) H2O2能清除路面空气中的CxHy、CO等,主要是利用了H2O2的____________(填“氧化性”或“还原性”)。

Ⅲ. 某研究性学习小组用下列装置模拟“生态马路”清除CO的原理。(夹持装置已略去)
(6) 若缓慢通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重16.5g,则CO的转化率为____________。
(7) 当CO气体全部通入后,还要通一会儿空气,其目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com