
| A. | CuSO4 | B. | NaCl | C. | CaCl2 | D. | 无 |
分析 ①取少量白色粉末放入试管里,加入适量蒸馏水,振荡得到无色溶液,因硫酸铜溶液为蓝色,则一定不含CuSO4,且CaCl2与K2SO4、Na2CO3不能同时存在;
②在上述溶液中加入足量氯化钡溶液有白色沉淀生成,再加足量硝酸,沉淀部分消失,可知白色沉淀为硫酸钡、碳酸钡,则原混合物一定含K2SO4、Na2CO3;
③取上层清液,滴加硝酸银溶液,有白色沉淀生成,再加硝酸,沉淀不消失,白色沉淀为AgCl,但②中加氯化钡引入氯离子,以此来解答.
解答 解:由①可知一定不含CuSO4,
由②可知一定含K2SO4、Na2CO3,则不含CaCl2,
由③中白色沉淀为AgCl,但②中加氯化钡引入氯离子,则不能确定是否含NaCl,
故选B.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,②中引入氯离子为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 该溶液中HA有0.1%发生了电离 | |
| B. | 此酸电离平衡常数约为10-7 | |
| C. | 升高温度后溶液的PH增大 | |
| D. | 若将PH=2的HA溶液与PH=12的NaOH溶液等体积混合后PH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使蒸发皿中的水分完全蒸干后,才能停止加热 | |
| B. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| C. | 往溶液中加入盐酸,若放出能使澄清石灰水变浑浊的无色无味气体,则原溶液中只含CO32- | |
| D. | 除去铜粉中混有的少量镁粉和铝粉可加入足量氢氧化钠溶液,反应后过滤、洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2CO3 和NaCl | B. | KCl和NaNO3 | C. | NaCl 和MgCl2 | D. | NaCl 和KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 1:4 | C. | 2:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
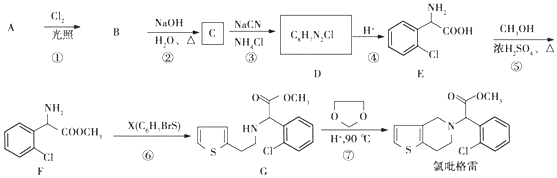
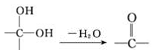 ;②
;②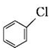 中氯原子较难水解;③RCHO$→_{NH_{4}Cl}^{NaCN}$
中氯原子较难水解;③RCHO$→_{NH_{4}Cl}^{NaCN}$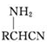
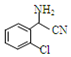 ;C分子中最多有14个原子共平面.
;C分子中最多有14个原子共平面.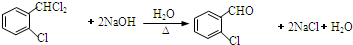 .
.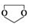 ,需要经历的反应类型有②①③④③(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有②①③④③(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物 的最后一步反应HOCH2CH2OH+HCHO$\stackrel{酸}{→}$
的最后一步反应HOCH2CH2OH+HCHO$\stackrel{酸}{→}$ .
.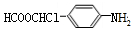 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为:
乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为: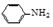 +CH3COOH?
+CH3COOH?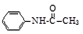 +H2O
+H2O| 名称 | 式量 | 性状 | 密度/g/cm3 | 沸点/℃ | 溶解度 | |
| 苯 胺 | 93 | 无色油状液体,具有还原性 | 1.00 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚等 |
| 乙 酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 | 易溶于乙醇、乙醚 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com