
| A. | Na2SO4═Na++SO4-2 | B. | BaCl2═Ba2++Cl2- | ||
| C. | Al2(SO4)3═2Al3++3SO42- | D. | K2S═2K+S |
分析 A.硫酸根离子的表示方法不规范,且应该为2个钠离子;
B.2g氯离子不能合并;
C.硫酸铝在溶液中完全电离出铝离子和硫酸根离子;
D.钾离子和硫离子没有标出所带电荷.
解答 解:A.硫酸钠为强电解质,完全电离,正确的电离方程式为:Na2SO4═2Na++SO42-,故A错误;
B.氯化钡完全电离出钡离子和氯离子,正确的电离方程式为:BaCl2═Ba2++2Cl-,故B错误;
C.硫酸铝完全电离,其电离方程式为:Al2(SO4)3═2Al3++3SO42-,故C正确;
D.硫化钾电离出钾离子和硫离子,正确的电离方程式为:K2S═2K++S2-,故D错误;
故选C.
点评 本题考查了电离方程式的书写方法,题目难度不大,明确电离方程式的书写原则为解答关键,注意掌握强弱电解质的判断方法,试题侧重基础知识的考查,培养了学生的规范答题能力.


科目:高中化学 来源: 题型:选择题
| A. | 构成单质分子的粒子一定含共价键 | |
| B. | 非金属元素组成的化合物一定不是离子化合物 | |
| C. | 第ⅠA族和第ⅦA族原子化合时一定形成离子键 | |
| D. | 共价化合物中一定不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol的羟基与1mol的氢氧根离子所含电子数均为9NA | |
| B. | 500mL0.1mol/L盐酸中,含有HCl分子数目为0.05NA | |
| C. | 1molNa被氧化生成NaNO3水溶液或NaCl,都失去NA个电子 | |
| D. | 1.0L1.0mol•L-1的NaNO3水溶液中含有的氧原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 水起着溶解NH4NO3,发生吸热现象以启动反应的作用 | |
| B. | 每还原1molNO3需氧化1molZn和1molNH4+ | |
| C. | 成烟物质是两性氧化物小颗粒 | |
| D. | 发烟物质是小锌粒,它由NH4NO3反应放热而蒸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸和硫酸的浓度都增大 | B. | 盐酸和硫酸的浓度都减大 | ||
| C. | 盐酸的浓度减小,硫酸的浓度增大 | D. | 盐酸的浓度增大,硫酸的浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
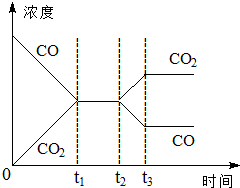 在一个恒容反应器中发生反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的平衡常数随温度的变化如表:
在一个恒容反应器中发生反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应的平衡常数随温度的变化如表:| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com