
| A. | 在氯化铝溶液中滴加氨水 | B. | 在偏铝酸钠溶液中通入CO2 | ||
| C. | 在氯化铝溶液中滴加氢氧化钠溶液 | D. | 在硫酸铝溶液中滴加偏铝酸钠溶液 |
分析 离子方程式4Al3++13OH-=AlO2-+3Al(OH)3↓+2H2O表示可溶性铝盐与强碱溶液的反应,强碱溶液必须部分过量,反应生成氢氧化铝沉淀,同时部分氢氧化铝溶解,据此进行解答.
解答 解:A.氯化铝与氨水反应的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,不能用4Al3++13OH-=AlO2-+3Al(OH)3↓+2H2O表示,故A错误;
B.偏铝酸钠溶液与过量二氧化碳反应的离子方程式为:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-,不能用4Al3++13OH-=AlO2-+3Al(OH)3↓+2H2O表示,故B错误;
C.在氯化铝溶液中滴加氢氧化钠溶液,二者按照物质的量4:13时的反应为:4Al3++13OH-=AlO2-+3Al(OH)3↓+2H2O,故C正确;
D.在硫酸铝溶液中滴加偏铝酸钠溶液,反应生成氢氧化铝沉淀和硫酸钠,反应的离子方程式为:Al3++6H2O+3AlO2-=4Al(OH)3↓,不能用4Al3++13OH-=AlO2-+3Al(OH)3↓+2H2O表示,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,明确离子方程式表示的意义为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的灵活应用基础知识的能力.


 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:实验题
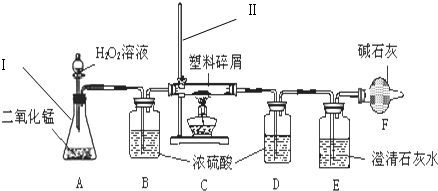
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
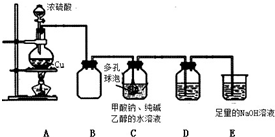
| 假 设 | 操作 | 现 象 | 原理 |
| Na2S2O4 为强 碱弱酸盐,其溶 液为碱性. | 取少量溶液于试管中,滴加 紫色石蕊试液 | 溶液变 成蓝色 | S2O42-水解,使溶液成碱性 |
| Na2S2O4 中 S 为 +3 价,具有较强 的还原性. | 取少量溶液于试管中,滴加过量新制氯水,再 滴加 BaCl2 溶液 | 有白色沉淀生 成 | 该反应的离子方程式依次为: 4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+ Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2L H2中含有的原子数为NA个 | |
| B. | 0.012kgC-14中约含有6.02×1023个碳原子 | |
| C. | 18g H2O中含有电子数为3NA个 | |
| D. | NA个氧气分子和NA个氢气分子的质量比等于16:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
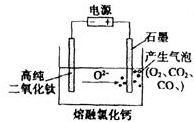 如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛.阴极的电极反应式为TiO2+4e-→Ti+2O2-,石墨电极的质量是否发生变化是 (填“是”或“否”).
如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛.阴极的电极反应式为TiO2+4e-→Ti+2O2-,石墨电极的质量是否发生变化是 (填“是”或“否”).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com