
科目:高中化学 来源: 题型:
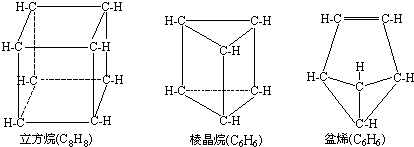
| A、①②③ | B、除①外都正确 |
| C、只有① | D、只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑦ | B、①④⑦ |
| C、②③⑥ | D、③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉的有效成分是次氯酸钙 |
| B、实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收 |
| C、钠、铁和铜一样都能在氯气中燃烧生成金属氯化物 |
| D、干燥的氯气可以使有色布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=4的氯化铵溶液中,c(H+)=c(NH3?H2O)=1×l0-4 mol?L-1 |
| B、pH=a的HCl溶液,稀释10倍后,其pH=b,则a=b+l |
| C、pH=2的HF溶液与pH=12的NaOH溶液体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-) |
| D、pH相同的①NaOH ②NaClO两种溶液中水的电离程度:①<② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 海水成分 | Na+ | Ca2+ | Mg2+ | HCO3- | Zn2+ |
| 含量/mol?L-1 | 0.4 | 0.002 | 0.045 | 0.002 | 10-7 |
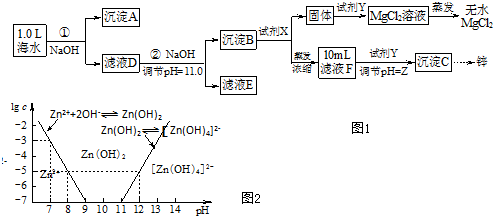
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由二氧化硫和氧气反应制三氧化硫需要使用催化剂 |
| B、棕红色NO2加压后颜色先变深后变浅 |
| C、SO2催化氧化成SO3的反应,往往需要使用催化剂 |
| D、H2、I2、HI平衡混合气加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
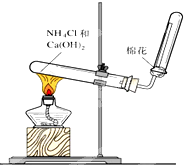 如图是实验室制取和收集氨气的装置图.回答下列问题:
如图是实验室制取和收集氨气的装置图.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4LO2中一定含有6.02×1023个氧分子 |
| B、将80gNaOH固体溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol/L |
| C、18gH2O在标准状况下的体积是22.4L |
| D、在标准状况时,20mLNH3与60mLO2所含的分子数之比为1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com