
【题目】汽车发动机在工作时,由于电喷,在气缸中会发生反应:N2(g)+O2 (g)=2NO(g).已知该反应过程中的能量变化如图所示,下列说法中不正确的是( ) 
A.该反应是放热反应
B.该反应是氧化还原反应
C.该反应过程中有共价键的断裂和形成
D.使用催化剂可以改变反应速率
科目:高中化学 来源: 题型:
【题目】2019年8月1日我国自主设计研制、具有国际主流水准的104架国产大型客机C919在上海浦东机场完成首次飞行实验。新材料的应用是C919的一大亮点,C919客机首次大范围采用的合金是( )
A.铝锂合金B.铜锌合金C.不锈钢D.铝镁合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组向同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。
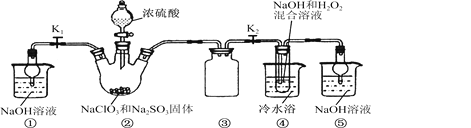
(1)装置③的作用是____________________。
(2)装置②中产生ClO2的化学方程式为________________ ;装置④中制备NaClO2的化学方程式为____________________。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品mg于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成250 mL待测溶液。②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
(3)该样品中NaClO2的质量分数为____________(用含m、c、V的代数式表示)。
(4)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列实验装置图,按要求作答: 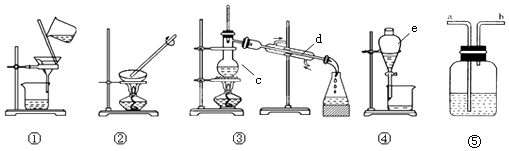
(1)装置中c、d、e的名称分别为、、
(2)分离下列物质,需要在哪套装置中进行 Ⅰ.干燥H2 , 可采用(填装置序号)装置
Ⅱ.除去食盐溶液中的水,可采用(填装置序号)装置
Ⅲ.淡化食盐水,可采用(填装置序号)装置
Ⅳ.实验室中的石灰水久置,液面上常悬浮有CaCO3微粒.可采用(填装置序号)装置除去Ca(OH)2溶液中悬浮的CaCO3微粒
Ⅴ.分离碘水中的碘应先选择装置(填装置序号) 进行和操作,再用装置(填装置序号)进行操作.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是
A. 皂化反应的产物是高级脂肪酸和甘油
B. 新戊烷与2—甲基丁烷为同一种物质
C. 酯化反应和酯的水解反应均为取代反应
D. 将苯与浓溴水混合能制取溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流储能电池利用不同价态离子对的氧化还原反应来实现化学能和电能的相互转化,充电时,惰性电极M、N分别连接电源的正极和负极。电池工作原理如图所示,下列说法不正确的是 ( )

A. 充电过程中,N电极附近酸性减弱
B. 充电过程中,N电极上V3+被还原为V2+
C. 放电过程中,H+由N电极向M电极移动
D. 放电过程中,M电极反应为VO2++ 2H++e-= VO2+ +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为Al2O3和杂质)为原料制备铝的一种工艺流程如下:

注:反应Ⅰ“碱溶”时杂质转化为沉淀
(1)反应Ⅰ,发生反应生成偏铝酸钠的离子方程式__________。
(2)电解Ⅰ是电解熔融的冰晶石和Al2O3的混合物,电解过程中作阳极的石墨易消耗,原因是___________。
(3)反应Ⅱ,用一定浓度的NaHCO3溶液处理过滤Ⅰ后的滤液,所得溶液pH和生成Al(OH)3的量随加入NaHCO3溶液体积变化的曲线如下:

①加入NaHCO3溶液体积小于8 mL时,发生主要反应的离子方程式__________。
②反应Ⅱ中生成Al(OH)3的离子方程式__________。
(4)电解Ⅱ是电解Na2CO3溶液,得到含NaHCO3的阳极液,原理如下图所示。

阴极产生的物质A的化学式为____________。
(5)以铝材为阳极,在H2SO4溶液中电解,可在铝材表面形成致密氧化膜,阳极电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类正确的是( )
选项 | 碱 | 酸 | 盐 | 酸性氧化物 |
A | 苏打 | 硫酸 | 小苏打 | 二氧化硫 |
B | 苛性钠 | 碳酸 | 胆矾 | 一氧化氮 |
C | 烧碱 | 硝酸 | 石灰石 | 二氧化硅 |
D | 纯碱 | 醋酸 | 碘化钾 | 一氧化碳 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com