
| A. | 增加H2的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 压强不变,充入氮气使容器体积增大 | |
| D. | 体积不变,充入氮气使容器压强增大 |
分析 对于3Fe(s)+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4(s)+4H2(g)来说,增大压强、浓度、升高温度以及增大固体的表面积,都可增大反应速率,以此解答.
解答 解:A.增加H2的量,即增大生成物浓度,则反应速率增大,故A不选;
B.将容器的体积缩小一半,气体浓度增大,反应速率增大,故B不选;
C.压强不变,充入氮气使容器体积增大,则容器体积应增大,气体浓度减小,反应速率减小,故C不选;
D.体积不变,充入氮气使容器压强增大,反应物和生成物浓度不变,则反应速率不变,故D选.
故选D.
点评 本题考查化学反应速率,为高频考点,侧重于学生的分析能力和基本理论、概念的综合理解和运用的考查,难度不大,注意相关基础知识的积累,易错点为C,注意压强与浓度的关系.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
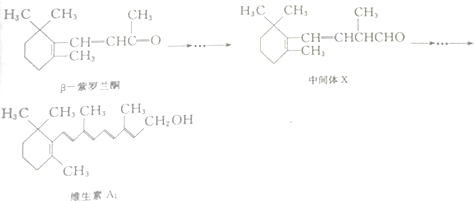
| A. | β-紫罗兰酮在核磁共振氢谱图中有7组峰 | |
| B. | β-紫罗兰酮与中间体X互为同分异构体 | |
| C. | 1mol中间体X最多能与2mol H2发生加成反应 | |
| D. | 维生素A1能发生取代反应、加成反应和氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是焓变为负值 | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应化学方程式为CO2(g)+H2(g) $?_{高温}^{催化剂}$ CO(g)+H2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
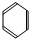
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.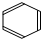 在浓硫酸作用下,与浓硝酸反应的化学方程式为:C6H6+HNO3$→_{50℃-60℃}^{浓硫酸}$C6H5NO2+H2O.
在浓硫酸作用下,与浓硝酸反应的化学方程式为:C6H6+HNO3$→_{50℃-60℃}^{浓硫酸}$C6H5NO2+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.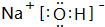 或
或 等,一种共价化合物的电子式为
等,一种共价化合物的电子式为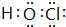 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的硝化反应是取代反应 | |
| B. | 在苯中加入酸性KMnO4溶液,振荡并静置后下层液体为紫色 | |
| C. | 78g苯(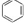 )中含有C=C双键的数目为3NA )中含有C=C双键的数目为3NA | |
| D. | 在一定条件下,苯能与氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaOH固体,平衡正向移动,溶液中c(H+)增大 | |
| B. | 加水,平衡正向移动,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$减小 | |
| C. | 通入少量HCl,平衡逆向移动,溶液中c(H+)减少 | |
| D. | 加入少量CH3COONa固体,平衡逆向移动,溶液导电能力减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com