
下列各项操作中, 不发生 “先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入 CO2至过量
②向Fe(OH)3胶体中逐滴加入稀盐酸至过量
③向 NaAlO2 溶液中通入 CO2至过量
④向 AlCl3溶液中加入 Ba(OH)2溶液至过量
⑤向 CaCl2 溶液中通入 CO2 至过量
A. ①③⑤ B. ①② C. ①③ D. ②③⑤
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源:2016-2017学年四川省乐山市高一上学期教学质检化学试卷(解析版) 题型:推断题
(6分)A、B、C、D、E五种物质中均含有同一种元素,其相互转化关系如下图所示:
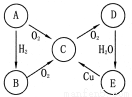
请回答下列问题:
(1)如果A是淡黄色固体,则B是(写化学式,下同) ,E是 。
(2)如果A是无色气体:B→C的化学方程式为 ;E→C的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省等三校高二上第二次联考化学试卷(解析版) 题型:填空题
铜及其化合物在工农业生产及日常生活中应用非常广泛。回答下列问题:
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,制取Cu2O的两种方法如下表所示。
方法I | 用炭粉在高温条件下还原CuO生成Cu2O和CO2 |
方法II | 用肼(N2H4)还原新制Cu(OH)2 |
① 方法I中还原剂与氧化剂的物质的量之比为________。
② 方法II发生反应的化学方程式为______________。
(2)氢化亚铜是一种红色同体,可由下列反应制备:
4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应中每转移3 mol电子,生成CuH的物质的量为___________mol。
(3)氯化铜溶液中各种含铜微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与c(C1-)之间的关系如图所示。
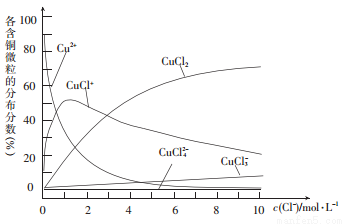
① 当c(C1-)= 9 mol/L时,溶液中3种主要含铜微粒浓度的大小关系为__________。
② 在c(C1-)= l mol /L的氯化铜溶液中,加人AgNO3溶液,CuCl+转化为Cu2+的离子方程式为____________。
(4)已知:Cu(OH)2是二元弱碱,25℃时Ksp[Cu(OH)2]=2.0×10-20。则此温度下在铜盐溶液中Cu2+发生水解反应的平衡常数为______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省等三校高二上第二次联考化学试卷(解析版) 题型:选择题
只用NaOH溶液不能除去下列各组物质中的杂质(括号内为杂质)的是
A.Mg(Al2O3) B.MgCl2(A1Cl3) C.Mg(Si) D.MgO(SiO2)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省等三校高一12月联考化学卷(解析版) 题型:填空题
化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是__________.(填化学式)
(2)“三酸”与“两碱”之间均可反应,酸过量时若用化学方程式表示有六个,若用离子方程式表示却只有两个,请写出这两个离子方程式_____________,_______________。
(3) “三酸”常用于溶解金属和金属氧化物.某化学兴趣小组在烧杯中放入铜屑和稀硫酸,加热并不断通入空气,观察到溶液逐渐变为蓝色,用化学方程式表示这一实验过程:_________________。
(4)烧碱可吸收CO2,当含0.2molNaOH的溶液吸收一定量CO2后,向溶液中逐滴滴加稀盐酸,下图表示加入盐酸体积和生成的CO2的体积的关系:
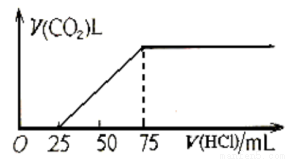
曲线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是__________,所用的稀盐酸的物质的量浓度为________(保留2位小数)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省等三校高一12月联考化学卷(解析版) 题型:选择题
在某种强碱性的无色透明溶液中,下列一定能大量共存的离子组是( )
A.K+、AlO2-、Cl-、NO3-
B.MnO4—、SO32-、K+、Cl-
C.Ba2+、CO32-、Cl-、K+
D.HCO3-、K+、SO42—、Cl-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省等三校高一12月联考化学卷(解析版) 题型:选择题
下列有关混合物的分离与提纯的说法正确的是
A. 碘在乙醇中的溶解度较大,可用乙醇把碘水中的碘萃取出来
B. 乙醇的沸点为 78.5℃,可用加生石灰蒸馏的方法使含水乙醇变为无水乙醇
C. 汽油和水不互溶,可用过滤的方法将二者分离
D. NaCl 的溶解度随温度下降而减小,可用冷却法从含少量 KNO3 的热饱和 NaCl 溶液中分离得到纯净的 NaCl
查看答案和解析>>
科目:高中化学 来源:2017届福建省宁德市高三上学期单科质检模拟化学试卷(解析版) 题型:实验题
为探究某铁碳合金与浓硫酸在加热条件下的反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究。
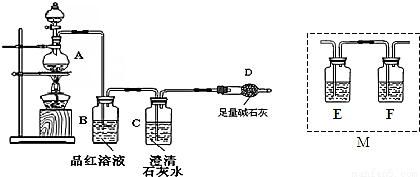
(1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下碳与浓硫酸不反应;② 。
(2)点燃酒精灯,反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是 。
(3)装置B的作用是 。
(4)甲同学观察到装置C中有白色沉淀生成,他得出了使澄清石灰水变浑浊的气体是二氧化碳。装置A中能产生二氧化碳的化学方程式为 。
(5)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B-C之间添加装置M。装置E、F中盛放的试剂分别是 、 。重新实验后观察到装置F中的现象是 。
(6)有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定。(5Fe2+ + MnO4- + 8H+=5Fe3+ + Mn2+ + 4H2O)。测定铁元素质量分数的实验步骤如下:
Ⅰ.往烧瓶A中加入过量铜使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
Ⅱ.将滤液B稀释为250mL;
Ⅲ.取稀释液25.00mL,用浓度为c mol·L-1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL。
① 步骤Ⅱ中,将滤液B稀释为250mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是 。
② 判断滴定终点的标志是 。
③ 铁碳合金中铁元素的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省杭州市五校高一上学期联考化学试卷(解析版) 题型:填空题
现有下列八种物质:①NaOH溶液 ②铁丝 ③液态HC1④熔融氯化钠 ⑤硫酸钠固体⑥CO2 ⑦酒精⑧生石灰。
(1)上述物质中,可导电的是________(填序号,下同)。
(2)上述物质中,属于非电解质的是__________。
(3)上述物质中,属于电解质但不导电的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com