
分析 (1)物质的量表示含有一定数目粒子的集合体;
(2)物质的量符号为n,单位是mol,将12g12C中含有的碳原子数称为阿伏加德罗常数,符号为NA,NA≈6.02×1023,单位mol-1;
(3)单位物质的量的物质的质量为摩尔质量,符号为M,单位为g/mol.
解答 解:(1)物质的量是一个物理量,它表示含有一定数目粒子的集合体,表示物质所含微粒数与阿伏伽德罗常数之比,
故答案为:含有一定数目粒子;
(2)物质的量符号为n,单位是mol,将12g12C中含有的碳原子数称为阿伏加德罗常数,符号为NA,阿伏加德罗常数的单位是mol-1,阿伏加德罗常数约等于6.02×1023mol-1,
故答案为:n;mol;NA;mol-1;6.02×1023mol-1;
(3)单位物质的量的物质的质量为摩尔质量,数值上等于其相对分子质量或相对原子质量,符号为M,单位为g/mol,
故答案为:M;g/mol.
点评 本题主要考查了物质的量、阿伏伽德罗常数、摩尔质量的概念,属于基本概念的考查,根据所学知识进行回答,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
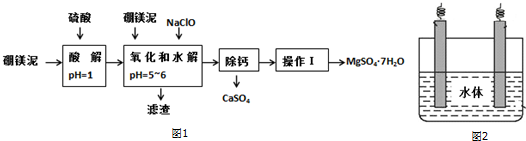
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
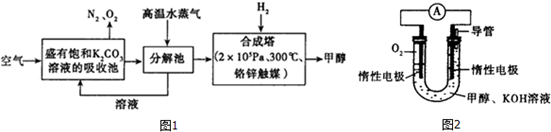
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需要的时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
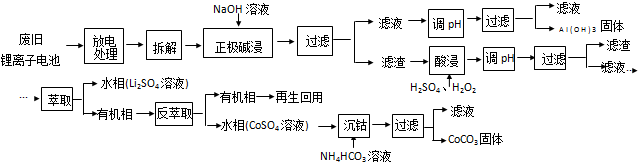
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”经过加工处理后,可以用来制肥皂 | |
| B. | “亚硝酸盐”可作某些食品的添加剂 | |
| C. | “84”消毒液的有效成分是NaClO | |
| D. | SO2用作食品增白剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com