
【题目】我国利用合成气直接制烯烃获重大突破,其原理是( )
反应①:C(s)+1/2O2(g)=CO(g) ΔH1
反应②:C(s)+H2O(g)=CO(g)+H2(g) ΔH2
反应③:CO(g)+2H2(g)=CH3OH(g) ΔH3=-90.1 kJ·mol-1
反应④:2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH4,能量变化如下图所示

反应⑤:3CH3OH(g)=CH3CH=CH2(g)+3H2O(g) ΔH5=-31.0 kJ·mol-1
下列说法正确的是( )
A. 反应③使用催化剂,ΔH3减小
B. 反应④中正反应的活化能大于逆反应的活化能
C. ΔH1-ΔH2<0
D. 3CO(g)+6H2(g)→CH3CH===CH2(g)+3H2O(g) ΔH=-121.1 kJ·mol-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】对可逆反应2SO2+O2≒2SO3,在混合气体中充入一定量的18O2,足够长的时间后, 18O原子()
A. 只存在于O2中 B. 只存在于O2和SO3中
C. 只存在于O2和SO2中 D. 存在于O2、SO2和SO3中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有5个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A的最高价氧化物的水化物是___________(填化学式);
(2)物质E中所包含的化学键有______________,写出C、D两元素形成的化合物C2D的电子式______________________;
(3)把盛有48mLAB、AB2混合气体的容器倒置于水中(同温、同压下),待液面稳定后,容器内气体体积变为24mL,则原混合气体中AB的体积分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X(分子式为C4H6O5)广泛存在于许多水果中,尤以苹果、葡萄、西瓜、山楂内为多。经测定该有机物具有下列性质(见下表)。请根据题目要求填空:
X的性质 | |
① | X与足量的金属钠反应产生氢气 |
② | X与醇或羧酸在浓硫酸加热条件下均能生成有香味的产物 |
③ | 在一定条件下X的分子内脱水产物(不是环状化合物)可与溴水发生加成反应 |
④ | 33.5gX与100mL的5mol/LNaOH溶液恰好完全中和 |
(1)X的可能结构简式I:________,Ⅱ:__________,Ⅲ:__________。
(2)在一定条件下有机物X可发生化学反应的类型有(填序号)__________。
A.水解反应 B.取代反应 C.加成反应 D.消去反应 E.加聚反应 F.中和反应
(3)下列物质与X互为同系物的是(填序号)_______,与X互为同分异构体的是(填序号)_______。
(a)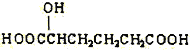 (b)
(b)![]()
(c)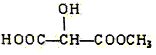 (d)H3COOC-COOCH3
(d)H3COOC-COOCH3
(e)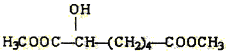 (f)
(f)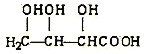
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下乙烯和溴水反应可以得到多种产物,各物质的转化关系如下图.

已知:E的结构简式为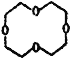 ,I的分子式为C4H4O4,是一种环状化合物。
,I的分子式为C4H4O4,是一种环状化合物。
请回答下列问题:
(1)E的分子式是__ ;B的结构简式是_________。
(2)在乙烯的同系物中,所有碳原子一定共平面且碳原子数最多的分子的结构简式是____,名称是________。
(3)在反应①~⑩中,属于取代反应的是⑥和_____(填写编号);
(4)写出反应⑩的化学方程式___________________。
(5)J是I的同分异构体,且1molJ与足量的NaHCO3溶液反应可放出2molCO2气体,请写出符合条件的J的所有的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某功能高分子 P 的合成路线如下:
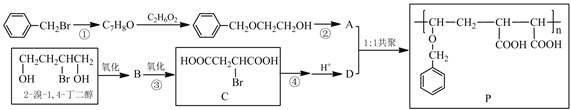
完成下列填空:
(1)反应①所需试剂与条件是______________;反应②的反应类型是______________。
(2)写出反应④的化学方程式。___________________________
(3)设计实验方案证明反应③中 B 是否已完全转化为 C。___________________________
(4)任写一种同时满足下列要求的 D 的同分异构体的结构简式。_____________________ i.属于酯类化合物 ii.分子中含有一个六元环
(5)写出由 1,3-丁二烯为原料制备 2-溴-1,4-丁二醇合成路线。
___________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A和B只由C、H、O中的两种或三种元素组成,等物质的量的A和B完全燃烧时,消耗相等物质的量的氧气,则A和B的相对分子质量的差值(其中n为正整数)不可能为 ( )
A. 0 B. 14n
C. 18n D. 44n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究非金属化合物在生产、生活中的应用具有实际意义。
(1) 为了减少空气中SO2的排放,将含SO2的烟气通过洗涤剂X,再加入稀硫酸,既可以回收SO2,同时又可得到化肥。上述洗涤剂X可以是________(选填序号)。
a. Ca(OH)2 b. K2CO3 c. NaHSO3 d. NH3·H2O
(2) 磷酸(H3PO4)是一种食品添加剂。它在水溶液中存在的各种微粒的物质的量分数δ随pH的变化曲线如下图。
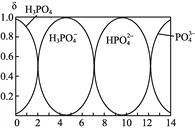
①向Na3PO4溶液中滴入稀盐酸,溶液pH从10降低到5的过程中发生的主要反应的离子方程式为__________________。
②从图中推断:NaH2PO4和Na3PO4两盐在同一溶液中________大量共存。(填写“能”或者“不能”)
(3) BrF3是优良的电解溶剂,具有强氧化性,与水反应的化学方程式为:
3BrF3+5H2O===HBrO3+Br2+9HF+O2↑,若反应中产生了1.5 mol O2,则被水还原的BrF3的物质的量是________mol。
(4) 二茂铁是一种金属有机配合物,可作燃料油的添加剂。二茂铁中配离子为C5H,其对应的环状分子C5H6的核磁共振氢谱如图1所示。C5H6与等物质的量Br2进行加成后的产物有M、N两种,M的核磁共振氢谱如图2所示。
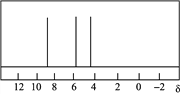
图1 图2
写出C5H6的结构简式________;分子M发生加聚反应产物的结构简式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化锌荧光材料的研究从1868年法国化学家Sidot发现至今已有近150年的历史。其中立方硫化锌的晶胞如图所示。请回答下列问题:

(1)锌元素在周期表中的位于第______周期_____族, 属于_____区;
(2)基态锌原子的价电子排布式为_________;
(3)一般锌元素常表现为+2 价的原因是_____;
(4)立方硫化锌晶体的每个晶胞中含有_____个锌离子, 其配位数为_____;含有_____个硫离子,其配位数为_____;
(5)根据神奇的“百度”显示,该晶胞的棱长a=541pm,S2-的半径约为184pm,则 Zn2+在此晶胞中的半径大约为______pm(精确到1pm)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com