
��֪��H2(g)��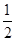 O2(g)=H2O(l) ��H1����285.8 kJ��mol��1 ��
O2(g)=H2O(l) ��H1����285.8 kJ��mol��1 ��
H2(g)=H2(l) ��H2����0.92 kJ��mol��1 �� O2(g)=O2(l) ��H3����6.84 kJ��mol��1 ��
H2O(g)=H2O(l) ��H4����44 kJ��mol��1 ��
����˵����ȷ����
A�������ĸ���Ӧ�������ȷ�Ӧ
B��1 molҺ̬H2����������1 mol��̬H2������
C��H2��ȼ����(��H)Ϊ��285.8 kJ��mol��1
D�������Һ��ȼ�յ��Ȼ�ѧ����ʽΪH2(l)��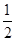 O2(l)=H2O(g) ��H����285.8 kJ��mol��1
O2(l)=H2O(g) ��H����285.8 kJ��mol��1
C
��������
���������A.�ڢۢ�������״̬�ı仯��û�����������ɣ��������仯������B��������Һ̬ת��Ϊ��̬��Ҫ�������������1 molҺ̬H2������С��1
mol��̬H2������������C.
ȼ������1mol��������ȫȼ�ղ����ȶ��Ļ�����ʱ���ų���������Һ̬��ˮ���ȶ�״̬�������ȷ��D. ��-�ڡ�1/2- ��- �ܣ������ɵã�H2(l)��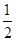 O2(l)=H2O(g) ��H����237.46kJ��mol��1.����
O2(l)=H2O(g) ��H����237.46kJ��mol��1.����
���㣺�����˹���ɵ�Ӧ�á��Ȼ�ѧ����ʽ����д��֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��֪��H2��g��+
��֪��H2��g��+| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��֪��H2��g��+
��֪��H2��g��+| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
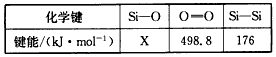
| ��ѧ�� | ���ܣ�kJ/mol�� | ��ѧ�� | ���ܣ�kJ/mol�� |
| N��N | 942 | H-O | 460 |
| N-H | 391 | O=O | 499 |
| H-H | 437 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ͬ���� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��H2(g)![]() 2H(g) ����1=+431.8 kJ��mol-1
2H(g) ����1=+431.8 kJ��mol-1
��![]() O2(g)
O2(g)![]() O(g) ����2=+244.3 kJ��mol-1
O(g) ����2=+244.3 kJ��mol-1
��2H(g)+O(g)![]() H2O(g) ����3=-917.9 kJ��mol-1
H2O(g) ����3=-917.9 kJ��mol-1
��H2O(g)![]() H2O(l) ����4=-44.0 kJ��mol-1
H2O(l) ����4=-44.0 kJ��mol-1
д��1 mol H2(g)������O2(g)����H2O(l)��Ӧ���Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com