
| A. | 两者都为s-sσ键 | B. | 两者都为p-pσ键 | ||
| C. | 前者为p-pσ键,后者为s-pσ键 | D. | 前者为s-sσ键,后者为s-pσ键 |
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:解答题
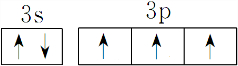 ,能量最高能层符号为M.
,能量最高能层符号为M.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种元素可组成CAB2和CAB3型化合物 | |
| B. | 离子半径:A3->B2->C+ | |
| C. | 氢化物稳定性:AH3>H2B | |
| D. | B的某种单质可用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝热反应原理是炼铁最常用的反应原理 | |
| B. | 氧化铝熔点很高,可用作耐火材料 | |
| C. | 过氧化钠可以用作呼吸面具中的供氧剂 | |
| D. | 青铜是我国使用最早的合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 霾是一种分散系,分散质是固体 | |
| B. | 雾是一种分散系,分散剂是液体 | |
| C. | 减少汽车尾气的排放可以减少雾霾天气的形成 | |
| D. | 减少生产生活中产生的扬尘可以减少雾霾天气的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 自从1962年首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙气的一系列化合物如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.
自从1962年首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙气的一系列化合物如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F、Cl、Br | B. | Al、Mg、Na | C. | N、S、Cl | D. | F、O、N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1moL苯乙烯(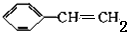 )中含有的碳酸双键数为4NA )中含有的碳酸双键数为4NA | |
| B. | 加热条件下,4.6g金属Na与足量O2反应的产物中阴离子的数目为0.1NA | |
| C. | 室温条件下,pH=9,体积为1L的CH4COONa溶液中,发生电离的水分子数为1.0×10-4NA | |
| D. | 高温条件下,16.6g铁粉与足量水蒸气反应后,转移电子数为0.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆,原理相似 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com