
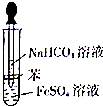
 某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按右图所示操作将NaHCO3溶液滴加到FeS04溶液中(FeS04和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.
某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按右图所示操作将NaHCO3溶液滴加到FeS04溶液中(FeS04和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉).观察到试管中立即出现白色沉淀,同时有大量无色气体生成.
分析 (1)亚铁离子和碳酸氢根离子发生双水解反应生成CO2;
(2)白色固体可能是Fe(OH)2和FeCO3的混合物;
(3)FeSO4和NaHCO3反应生成Fe(OH)2沉淀、二氧化碳和硫酸钠;二价铁不稳定,易被氧气氧化而干扰实验;碱性条件下,亚铁离子生成Fe(OH)2沉淀;
(4)如果白色沉淀是Fe(OH)2,Fe(OH)2不稳定,极易被氧化生成Fe(OH)3;FeCO3在干燥空气中稳定,潮湿环境中需较长时间才能被氧化为Fe(OH)3,通入空气后根据白色固体变色时间长短判断白色沉淀成分.
解答 解:(1)亚铁离子和碳酸氢根离子发生双水解反应生成CO2,所以生成的气体是CO2,故答案为:CO2;
(2)白色固体可能是Fe(OH)2和FeCO3的混合物,所以假设3为白色固体是Fe(OH)2和FeCO3,
故答案为:Fe(OH)2和FeCO3;
(3)FeSO4和NaHCO3反应生成Fe(OH)2沉淀、二氧化碳,根据元素守恒知还生成硫酸钠,反应方程式为FeSO4+2NaHCO3=Fe(OH)2↓+Na2SO4+2CO2↑;
二价铁不稳定,易被氧气氧化而干扰实验,所以经煮沸后冷却的蒸馏水配制FeSO4和NaHCO3溶液的目的是除去水中溶解的氧气,防止生成的氢氧化亚铁被迅速氧化;
反应体系进行了无氧处理并且碳酸氢钠水解提供了碱性环境,所以白色沉淀中一定含有氢氧化亚铁,
故答案为:FeSO4+2NaHCO3=Fe(OH)2↓+Na2SO4+2CO2↑;除去水中溶解的氧气,防止生成的氢氧化亚铁被迅速氧化;不同意;反应体系进行了无氧处理并且碳酸氢钠水解提供了碱性环境;
(4)如果白色沉淀是Fe(OH)2,Fe(OH)2不稳定,极易被氧化生成Fe(OH)3;FeCO3在干燥空气中稳定,潮湿环境中需较长时间才能被氧化为Fe(OH)3,通入空气后根据白色固体变色时间长短判断白色沉淀成分,所以其实验步骤、预期现象和结论为:向生成的白色沉淀的试管中通入空气,若白色沉淀迅速变成灰绿色,最后变为红褐色,则假设2不成立;若白色沉淀短时间内不变色,则假设2成立,
故答案为:向生成的白色沉淀的试管中通入空气,若白色沉淀迅速变成灰绿色,最后变为红褐色,则假设2不成立;若白色沉淀短时间内不变色,则假设2成立.
点评 本题考查性质实验方案设计,侧重考查学生分析、判断及实验操作能力,明确实验原理及物质性质是解本题关键,难点是实验方案设计,要利用物质性质的不同点设计方案,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定存在① | B. | 至少存在②和⑤ | C. | 无法确定是否有③ | D. | 至少存在①、④、⑤ |
查看答案和解析>>
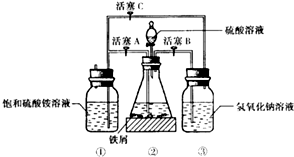
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| 摩尔盐 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的Na2S溶液:c(Na+)=2c(HS-)+2c(S2-)+2c(H2S) | |
| B. | 常温下,pH=2的盐酸和pH=12的氨水等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-1的NH4NO3溶液:c(NH4+)=c(NO3-) | |
| D. | 常温下,pH=3的H2SO3溶液:c(H+)=c(HSO3-)=1×10-5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
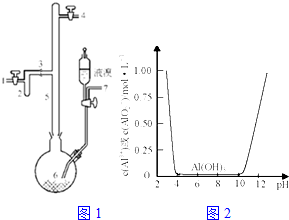 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的最外层电子数:X>Y>Z | B. | 单质沸点:Z>Y | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | (1) | (2) | ||||||
| 三 | (3) | (4) | (5) | (6) | (7) | (8) | (9) | |
| 四 | (10) | (11) | (12) |
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com